|
|
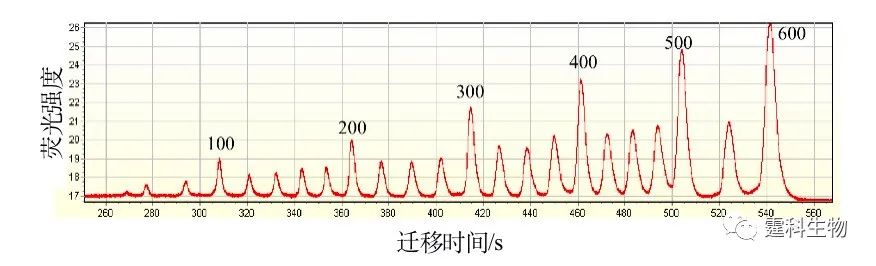
图解微流控|第20期发表时间:2021-11-12 14:13 微分离技术(二) 7.3.1.2 介质筛分芯片电泳 筛分电泳是利用生物大分子和筛分介质(高分子溶胶或凝胶)之间的动态交缠作用,把被分离物质按照分子量大小分开的一种技术,它是传统的平板电泳和毛细管电泳中研究最多,应用最广的一种电泳分离模式。 早在1990年代,作者实验室即在毛细管筛分电泳领域开展了一系列工作,在开展微流控芯片研究后,这一方面的积累被迅速移植到芯片筛分电泳中,并很快地被应用到临床实际样品的检验中,取得了一系列很好的结果,下面选择若干例子予以介绍。 (1)标准片段 作者实验室利用自行设计、研制的微流控芯片系统和聚合物PMMA 微流控芯片,在羟丙基甲基纤维素(HPMC)筛分体系上分离双链核酸,图7-10是标准核酸片段 ILS 600 STR DNA Ladder (Promega)的芯片电泳图,片段长度和分离时间呈很好的线性关系,对于核酸片段的定性十分有益。
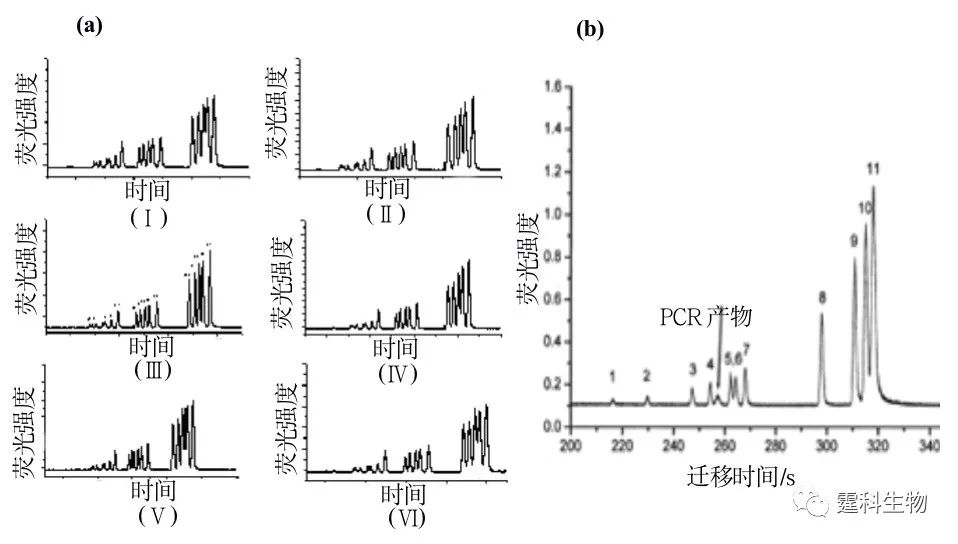
图7-10 ILS 600 STR DNA标准片段在2% HPMC-50筛分介质中的芯片电泳分离图 (2)结核杆菌PCR产物的定性 作者实验室以PBR322/HaeIII 为分离对象,四种不同分子量的HPMC溶液为筛分介质,对它们在微流控芯片电泳中的筛分性能进行了比较[9],见图7-11(a),在2% HPMC体系中加入6%的葡萄糖添加剂,用于结核杆菌PCR产物的定性,见图7-11(b),在微流控芯片中完成整个分离只需要200 s,而在传统毛细管电泳中完成相同DNA片段的分离大约需要27 min,约是芯片电泳分离所需时间的8倍。
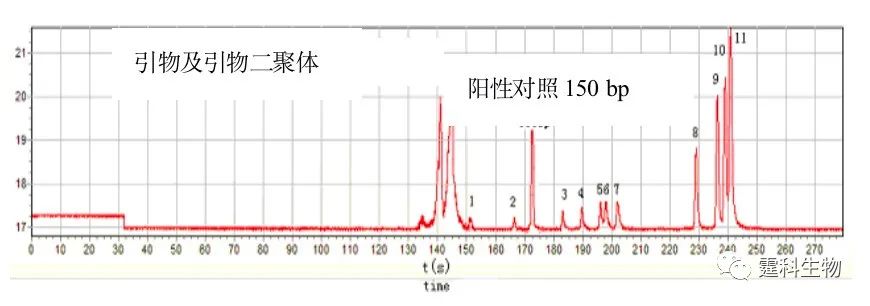
图7-11 结核杆菌PCR产物的定性 (a) PBR322/HaeⅢ DNA标准片段在2% HPMC-5 +不同浓度葡萄糖筛分介质中的芯片电泳分离图[9],(Ⅰ) 2%,(Ⅱ) 4% ,(Ⅲ) 6%,(Ⅳ) 8%,(Ⅴ) 10%,(Ⅵ) 12%;(b) 结核杆菌PCR产物和DNA标准品混合物的电泳谱图[9] (3)基因分析 作者实验室利用自行研制的芯片电泳系统成功开展肿瘤甲基化p16基因分析,并与现行的平板凝胶电泳方法进行了比较[10]。检测结果表明芯片电泳在诊断敏感性和特异性方面保持了现行平板凝胶电泳的水平,而检测灵敏度和检测准确度比现行的方法分别高40倍和26.6%(图7-12)。芯片电泳具有样品用量少、快速(分析时间少于170 s)、高灵敏的特点,为肿瘤的早期诊断提供了一种新的方法。
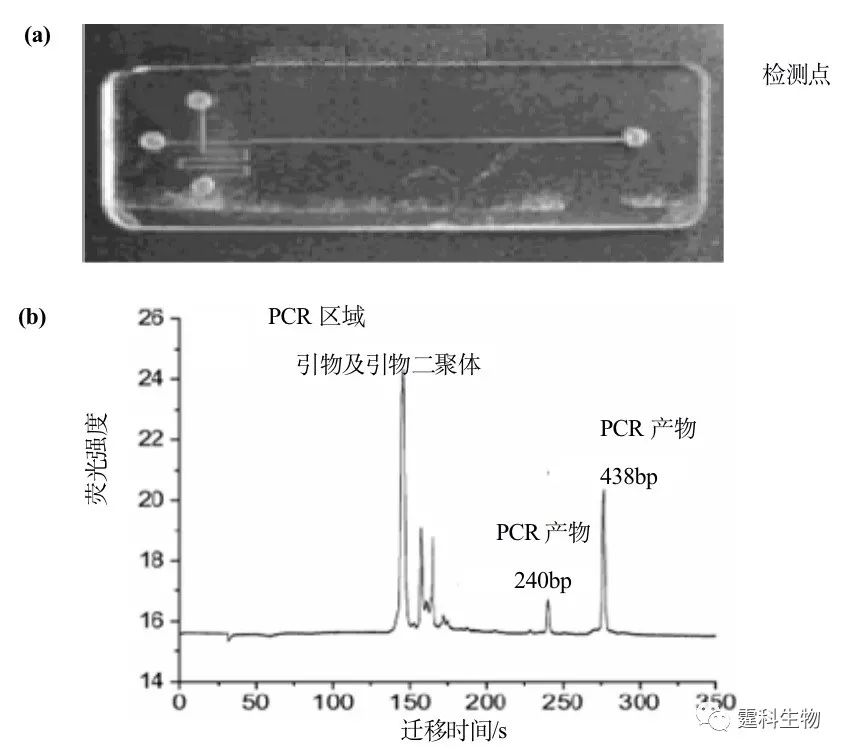
图7-12 阳性对照与标准品共同电泳图[10] 注:取1:3稀释的阳性对照产物样品5 µL与0.5 µg/µL的标准混合,置芯片样品池中进行电泳分析。从图中可看出DNA标准品的11个片段在250 s内全部分离完毕,而且其峰均达到基线分离;PCR产物在172 s出现,峰位于118 bp和194 bp片段之间 (4)SARS病毒 作者实验室构建了一套芯片PCR-芯片电泳系统,该系统包括芯片热循环仪、玻璃电泳芯片、激光诱导荧光芯片仪、PCR试剂盒和DNA分离检测试剂盒。实现了在同一芯片上进行聚合酶链反应(PCR)和产物的电泳分离检测。为了提高检测SARS病毒的可靠性,设计了两对PCR引物并在芯片上实现了在单对引物PCR反应基础上进行双重PCR反应与产物的在线分离检测[11]。以SARS病毒cDNA作阳性对照,副流感病毒作阴性对照,利用自行研制的芯片PCR-电泳芯片系统检测了18例临床SARS诊断病人咽拭纸样品,并与常规逆转录PCR结果进行了比较(图7-13)。芯片电泳系统检测出了17例阳性结果(17/18,94.4%),而常规逆转录PCR只检测出了12例阳性结果(12/18,66.7%),表明芯片PCR-芯片电泳方法是一种快速、灵敏和特异性强的检测SARS病毒的新方法。
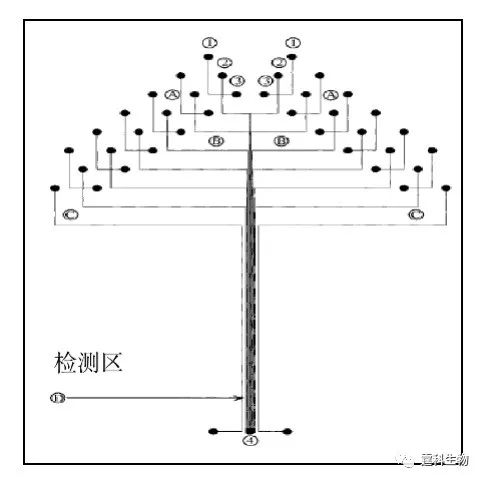
图7-13 芯片PCR-电泳芯片系统检测SARS病毒cDNA[11] (a) PCR芯片实物图;(b) 芯片电泳在线检测SARS病毒cDNA电泳谱图 (5)基因分型 Mathies研究组[12]构建了12通道的阵列芯片电泳(图7-14),采用分离通道并行、进样部分分立,长度补偿设计,而且共用一个分离废液池。他们采用共聚焦激光诱导荧光双色检测,芯片平台移动,单通道检测频率20次/s,成功实现了12通道同时分离核酸标准片段pBR322 MspI DNA ladder,并且对HLA-H基因进行了分型研究。
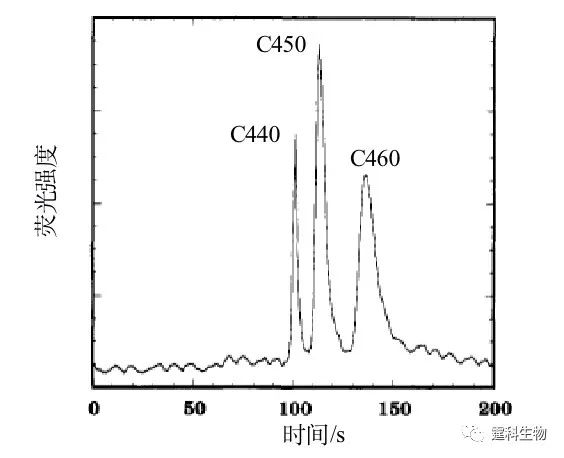
图7-14 12通道阵列电泳芯片的光刻图案[12] 进样通道长8 mm,分离通道长60 mm,最外侧为光对准通道,有效分离长度45 mm 在此基础上他们把芯片通道增加到48条,优化了电极及储液池的设计,检测频率为40次/s。后来将并行的通道改进为辐射状,通道数增加到96,并且优化了进样和转角设计,将芯片平台移动改为四色检测头转动,完成96通道的双链标准片段检测[13],并实现96通道400个碱基四色测序,准确率达99.99%[14]。他们采用7 cm分离通道优化的单通道测序条件(40℃,4%线性丙烯酰胺,100 mm双T进样,160 V/cm分离场强),20 min内实现600碱基完全测序[15]。 7.3.1.3 电色谱 基于被分离物荷质比差异的自由溶液区带电泳分离,对一些强疏水物质不是很有效。这就需要在电泳过程中引入色谱分配的概念,利用不同组分分配系数的差异强化分离。芯片电动色谱就是芯片电泳和液相色谱在某种程度的结合,充分利用了MEMS技术的高精确度、设计灵活等优势,突破了某些传统电色谱加工模式的束缚,以电渗驱动代替压力驱动。芯片电色谱有三种基本模式:开管电色谱、填充电色谱和整体电色谱。 (1) 开管电色谱 开管电色谱是直接在芯片微通道表面制备固定相,不需要固定相填充或聚合,相对简单,节省了很多后处理步骤;但是这种固定相的交换容量有限,因此对样品的浓度、进样的体积有很大的限制。Ramsey等[16]在早期完成了第一个芯片电色谱工作,他们在玻璃芯片的内通道表面键合了反向固定相十八烷基硅烷,流动相是10 mM的硼砂(pH 9.2),25%乙腈,直接检测多环芳烃香豆素(图7-15)
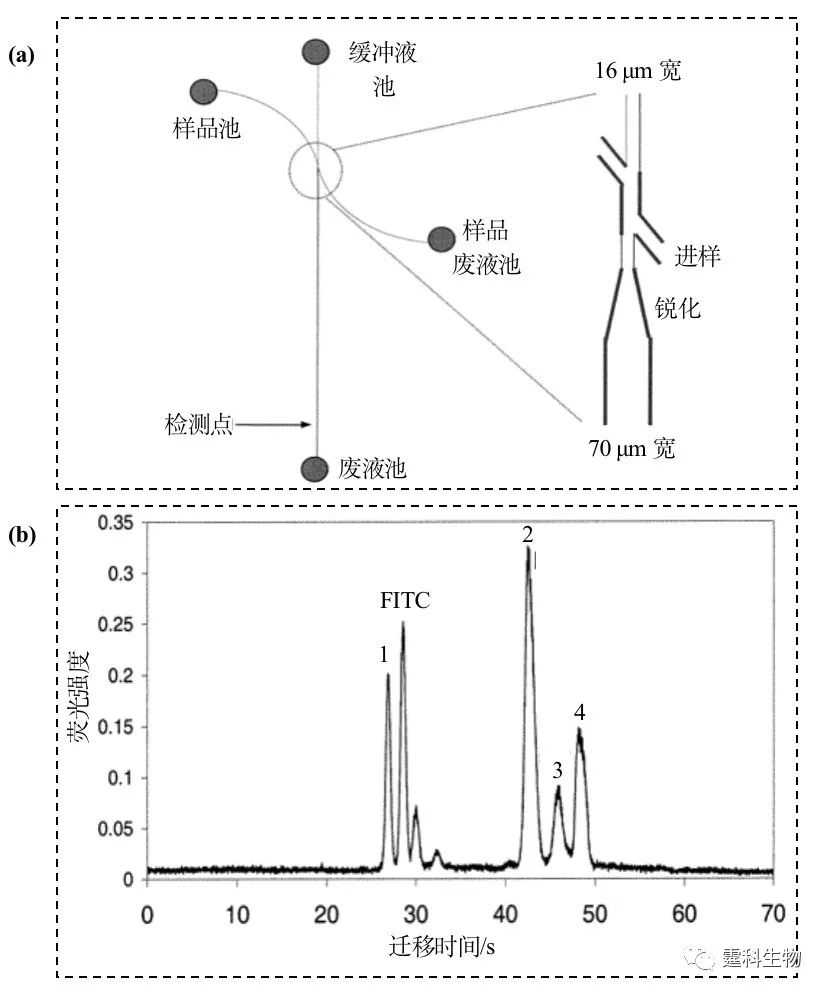
图7-15 电色谱分离C440, C450和 C460[16] (2)填充电色谱 填充电色谱的制作和传统的色谱类似,需要在芯片的微通道中装填固定相颗粒,由于色谱技术高度成熟,色谱固定相的选择范围很大;当然装填的难度比较大,特别是在普通实验室,难以保证重现性;这种技术需要设计塞子以挡住色谱颗粒,往往有一定难度。 芯片填充电色谱的优点在于可以采用微加工技术将柱塞一次性地加工在芯片上,既保证了重现性,又提高了成功率。由于填充柱电色谱同时具备固相萃取的功能,因此可以在柱前进行样品浓缩,显著提高柱容量。 有人在PDMS微通道中填入已经处理的3 µm的硅球[17],十八烷基化的硅球在通道变细的地方流动受阻,相互聚集从而在细道口挡住固定相,据此可进行了氨基酸混合物的芯片电泳分离,在15 s内分离了甲醇和苯甲醛,图7-16是其具体结果。
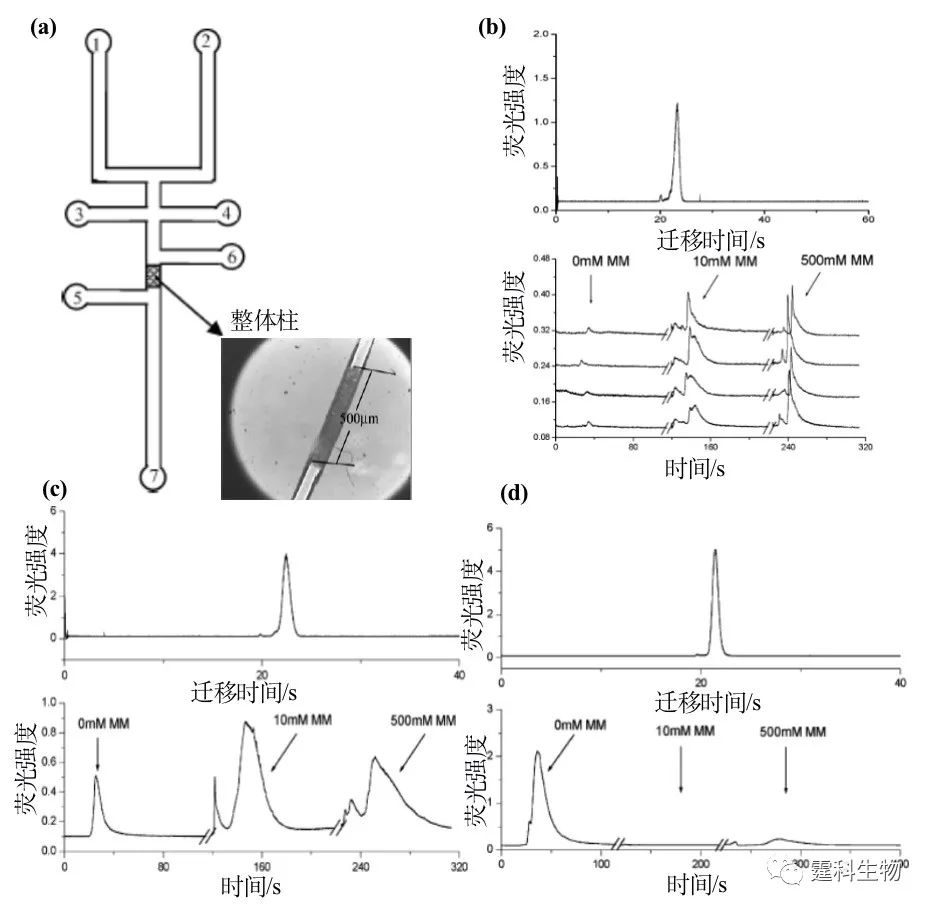
图7-16 芯片填充电色谱分离氨基酸[17] (a) 无塞型CEC芯片示意图,斜双T型进样,利用“楔石效应”挡住填料;(b) FITC标记的氨基酸混合物的电泳谱图,1.精氨酸,2.苯基丙氨酸,3.丝氨酸,4.氨基乙酸 (3)整体电色谱 将丙烯酸酯之类的单体、交联剂、制孔剂和光引发剂等混合后充入微通道,在紫外光的照射下引发丙烯酸酯类单体和交联剂聚合成型,反应完成后将未聚合的单体和小分子洗掉,得到整体柱。整体柱的优点是容量大、可以在微通道中精确定位、无须“塞子”。整体柱电色谱模式可以通过改变聚合物成分组合控制固定相孔径、带电情况和色谱分离基团,适用范围更广;不足之处是无论是光引发还是热聚合,要求的条件都很苛刻,其制备的工艺相对复杂,柱与柱之间的重现性比较差。 作者课题组[18]设计并制作了一种集成化凝集素亲和芯片,该芯片将传统的凝集素亲和色谱以微流控芯片的形式实现并用于糖蛋白糖形的分离。以紫外光引发在微流控芯片的通道内制备一段500 mm的GMA-EDMA(glycidyl methacrylate-ethylene dimethacrylate)整体柱,将凝集素-豌豆凝集素(pisum sativum agglutinin,PSA)固定在整体柱上,以电渗作为驱动力,鸡卵白蛋白、火鸡卵白蛋白和鸡卵粘蛋白等三种含有不同类型糖链的糖蛋白为对象,在该芯片上进行糖形的凝集素亲和色谱分析,所有糖蛋白的糖形根据与固定的豌豆凝集素亲和力的不同分为不同的组份(图7-17)。这种集成化的微流控芯片将传统的凝集素亲和色谱需要的几个小时的分析时间缩减为几分钟,耗时仅为原来的3%;仅需要300 pg的糖蛋白;大大简化了传统的凝集素亲和色谱的繁琐操作过程。
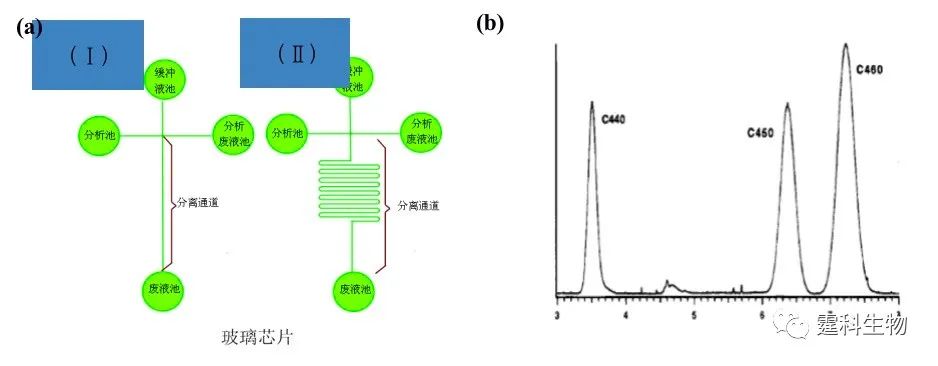
图7-17 集成化凝集素亲和芯片分离糖蛋白糖形[18] (a) 微流控芯片示意图,1.运行缓冲液池(R1),2.洗脱缓冲液池(R2),3.样品池(R3),4.样品废液池(R4),5-6.冲洗液池,7.废液池(R7);(b-d) 芯片区带电泳和豌豆凝集素亲和芯片分离的电泳图谱。(b) 为火鸡卵白蛋白,从其芯片区带电泳谱图上可以看出火鸡卵白蛋白仅是单一的峰,表现为均一性,而经过豌豆凝集素亲和柱时所有的糖形都被亲和吸附,经10 mM和500 mM的a-甲基甘露糖苷洗脱分别得到与豌豆凝集素弱结合和强结合的两个组分,从图中可以看出该凝集素芯片的重现性比较好。(c)、(d)情况类同,但(c)为鸡卵白蛋白,(d)为卵粘蛋白 7.3.1.4 胶束电动芯片色谱(MEKC) 表面活性剂加到缓冲液中,当浓度足够大时,其分子会聚集在一起,形成一个球体,称之为胶束(micelle)。 在含有胶束的缓冲溶液中实际上存在着类似于色谱的两相,一是流动的水相,另一相是起到固定相作用的胶束相,溶质在这两相之间分配,由其在胶束中不同的保留能力而产生不同的保留值[2]。当加入的离子型表面活性剂是SDS时,所形成的是内核疏水外部带负电的胶束相。这种由胶束作为移动的“固定相”的色谱被称之为胶束色谱,因为其动力源是电渗,所以又被称之为胶束电动色谱。通常在毛细管内实现,芯片胶束电动色谱是这种色谱形式的芯片化。 (1) 芯片梯度洗脱电色谱 早年就有报道称在玻璃芯片上用胶束电动色谱分离三种中性分子[19]:香豆素440、450和460,分离缓冲液是10 mM 硼砂,50 mM 的SDS,加入甲醇可调节这些中性分子在SDS胶束中的分配,图7-18是相应的芯片和所得的结果。
图7-18 玻璃芯片上分离香豆素[19] (a) 分离所用的玻璃芯片示意图,(Ⅰ) 适合用于高场强分离,(Ⅱ) 适合用于低场强分离;(b) 玻璃芯片上分离香豆素所得谱图 有人将梯度洗脱和MEKC结合起来,用以分离五种不同的香豆素,这样可以提高分离的效率,减少分离的时间[20],如图7-19所示。
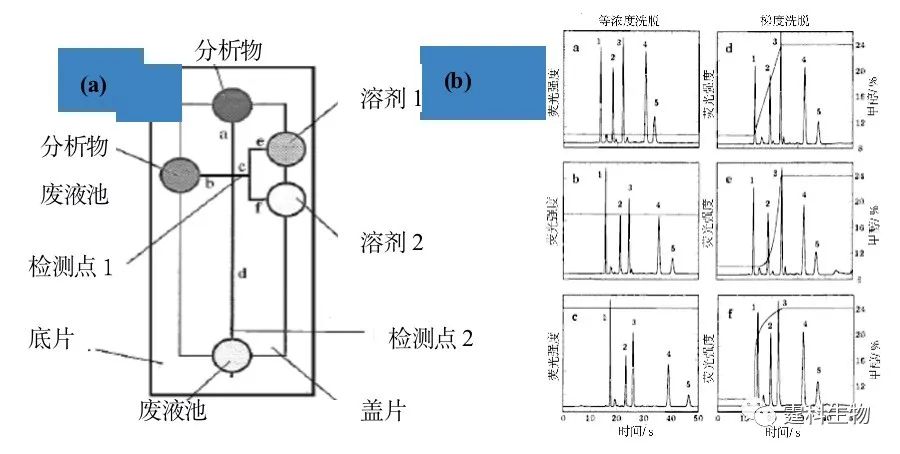
图7-19 恒定和梯度洗脱电色谱分离五种香豆素[20] (a)芯片示意图;(b) 等浓度洗脱和梯度洗脱分离香豆素对比图 1.C440;2.C490;3.C450;4.C460;5.C480 (2)同步循环胶束电动色谱 同步循环胶束电动色谱是一种环行分离模式,它可以在一首尾相连的分离通道内,通过切换电压,实现多次循环分离,从而增加分离距离,提高分离效率。当然,这种循环分离要求检测与电压切换的精确反馈与自动控制。 早在1996年就有人尝试在微流控芯片上用同步循环胶束电动色谱分离氨基酸[21](图7-20),取得了非常好的结果。实验的核心在于在一个环形的微通道上,相互嵌套一组高压电极,实验设计了一套精确控制高压的程序,将已分离的组分引出循环,而将其余组分留在循环电泳中继续分离,直到所有的组分都被完全分开。当然这样的芯片结构也存在一个弊端,即转角效应会随着循环次数增加而不断累积,最终导致分离效率下降。
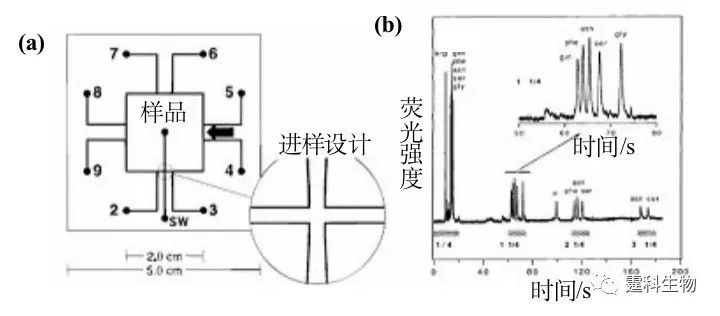
图7-20 同步循环胶束电动色谱分离氨基酸[21] (a) MEKC芯片示意图,环行通道80 mm长,通道上下宽40/20 μm,深10 μm,进样12 pL,SW.样品废液池,箭头表示检测,3,5,6,8和SW加高压,缓冲液由2,4,7,9加入;(b) 氨基酸电泳图,MEKC缓冲液为75 mM SDS,10 mM Na2HPO4,6 mM Na2B4O7 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |