|
|
图解微流控|第19期发表时间:2021-11-05 13:27 微分离技术(一) 早期的微流控芯片,在某种意义上来说就是一种微分离器件,电泳则是芯片微分离中采用最普遍的一种形式。实际上微流控芯片实验室研究工作就是从芯片电泳开始的,它的最早一轮应用,也是在芯片电泳上展开的。以电泳分离为主体的分离技术已经成为微流控芯片实验室中发展最快,成熟度最高的一类技术单元,在整个芯片平台技术的研究中占有特殊的地位。 7.1 概述 与传统的单一分离模式相比,微流控芯片电泳分离技术至少具有下述几方面的特点: 1. 它通常作为微流控芯片系统众多功能单元中的一个单元存在; 2. 它的载体材料丰富,有石英、玻璃、硅和各种聚合物; 3. 它的各种分离模式易于实现,过程控制简单; 4. 它可和其他操作单元灵活组合、规模集成,应用范围大幅度扩展。 发展至今,几乎所有的电泳分离模式和很大一部分色谱分离模式都已在芯片上实现,包括膜分离在内的其它各种分离单元也已在芯片上出现。 据不完全统计,迄今为止芯片微分离技术的研究,约有90%集中在电泳领域。电泳技术的一些特点决定了它至今仍然是微流控芯片中分离单元的主体[1]。本章将着重讨论芯片电泳分离模式,并适当涉及相关的色谱技术,膜分离等其他模式将安排在进样和样品处理技术等章节阐述。
图7-1 作者实验室自主开发的用于电泳分离的各种芯片实物图
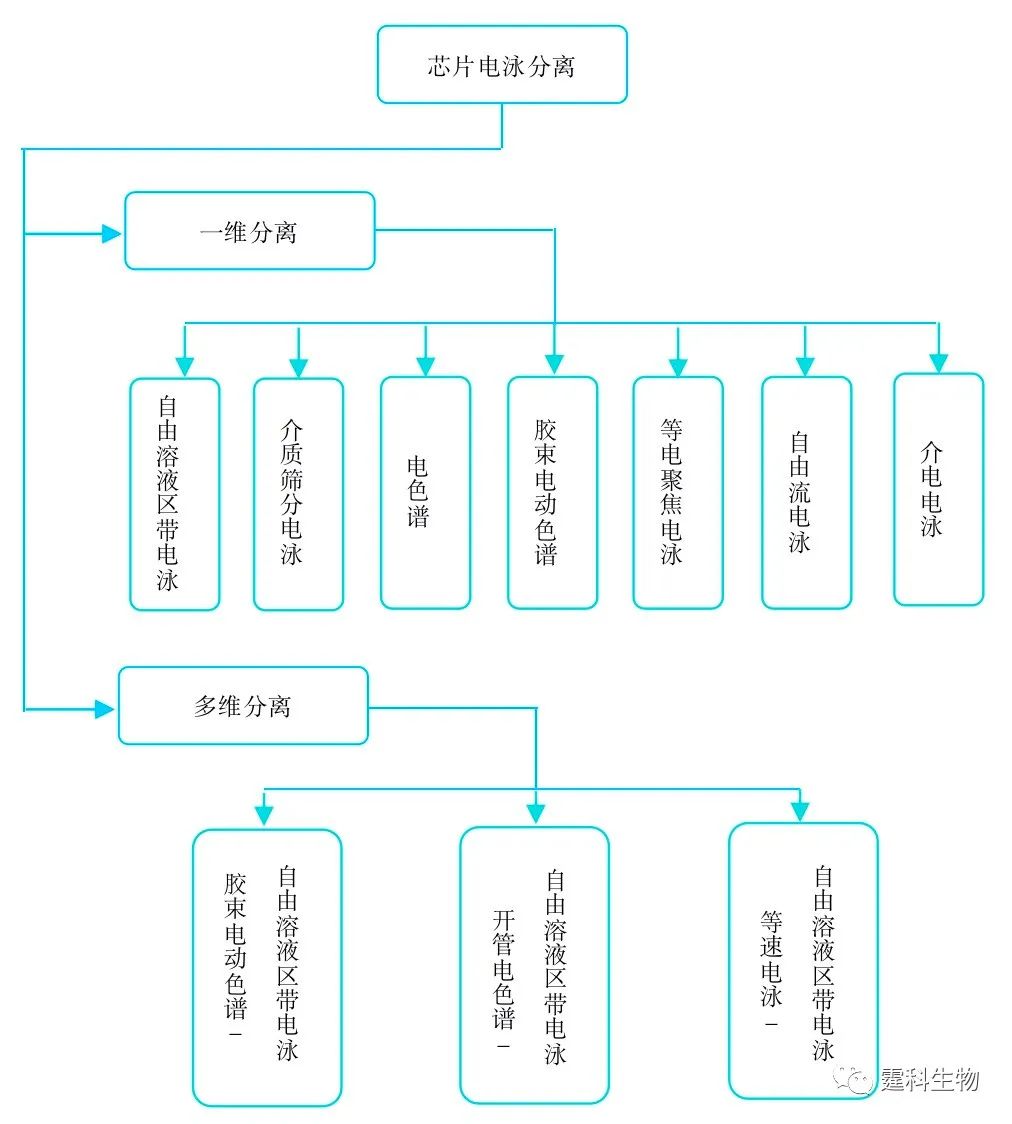
图7-2 芯片电泳分离分类一览 注:多维芯片电泳分离以二维分离为主,在本章主要集中讲述二维芯片分离模式 7.2 电泳分离的基本问题 电泳过程的宏观表现形式是谱带。谱带通常是指被分离组分分子在分离通道中的空间分布,这种空间分布随时间的变化被称之为谱带迁移,谱带迁移过程中空间分布的变化被称之为谱带展宽。 7.2.1电泳的谱带迁移 电泳是电介质中带电粒子在电场作用下以不同的速度定向迁移的现象(图7-3)。利用这种现象对化学或生物组分进行分离或进而进行分析的技术称为电泳[2]。为了精确表述物质分子在电介质中泳动的程度,将单位电场下的电泳速度定义为电泳淌度,电泳淌度近似正比于z/m1/2(Z为电荷数,M为分子质量),这是实现电泳分离,严格地说,是实现自由溶液区带电泳分离的基础,因为理论上不同的分子的z/m1/2总是有差别的。
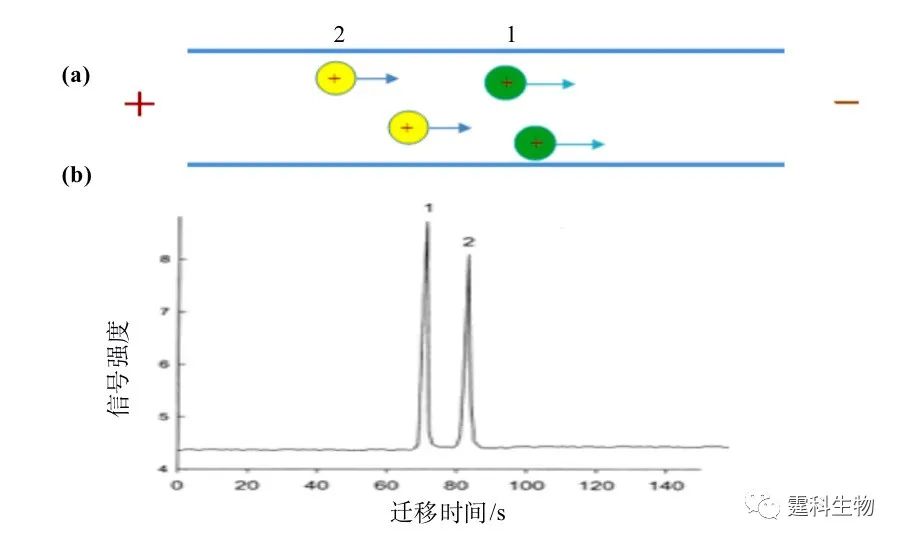
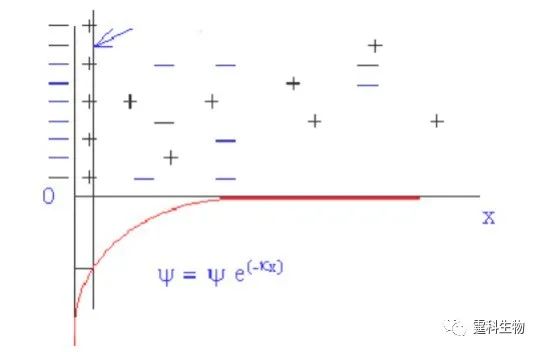
图7-3 电泳分离示意图 (a) 分离通道中,在一定电场强度下,1、2两种离子发生定向迁移;(b) 检测点处记录信号强度,由于迁移速度的不同,从而得到分离,表现为出峰时间先后不同 广义地讲,电渗是一种液体相对于带电的管壁移动的现象,电渗的产生和偶电层有关[3]。偶电层是浸没在液体中的所有表面都具备的一种特性,通常是指两相之间由相对固定和游离的两部分离子组成的与表面电荷异号的离子层(图7-4)。如果有沿固体表面的电场存在,液体中净电荷必然在电场力作用下作定向移动,由于液体的黏度,这种移动往往会带动靠近表面的几十微米的液体一起进行,当静电力与液体移动受到的摩擦力达到平衡时,整个液体做匀速运动。谱带的迁移是电渗和电泳共同作用的结果。
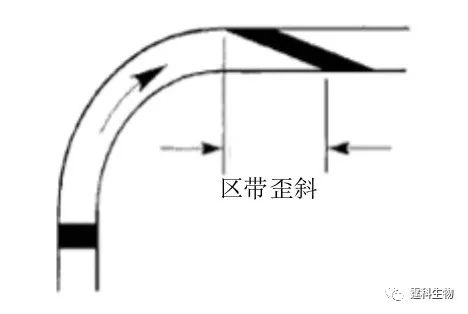
图7-4 ζ电势分布曲线图 定义相对固定的离子和相离最近的游离离子之间的区间所存在的电势为ζ电势 7.2.2电泳的谱带展宽 影响谱带展宽的因素有两类,一类是一般因素,包括柱内的扩散、自热、吸附和柱外的进样区带长度、检测窗口宽度等。就一般因素而言,芯片电泳和毛细管电泳没有本质的差别,可以借鉴相关论著的阐述。特殊因素指的是弯道效应和不同材料的不同吸附。弯道效应指的是组分分子在微通道内外两侧因路径长度差异而造成的组分空间分布变化,在芯片中由于空间有限弯道增加,曲率半径增大,使其对谱带展宽的影响更为严重(图7-5)。弯道所引起的区带展宽和通道的直径成正比,相应的克服办法是减少弯道宽度或进行路径补偿。关于吸附的问题,本书的第3章有较为详细的介绍。
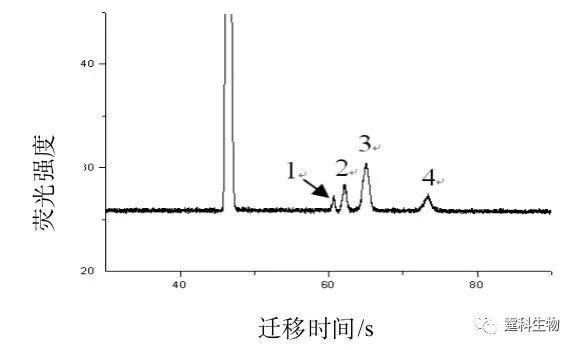
图7-5 弯道对分离区带的展宽效应示意图 样品区带经过弯道后发生扭曲,贴近通道内侧的样品部分明显凸前,而靠近通道外侧组分则会滞后 7.3 芯片电泳分离常见模式 7.3.1 一维芯片电泳 一维芯片电泳与传统的毛细管电泳没有本质的区别,不同的分离模式可以看作是因通道内分离介质的不同而造成的分离机理和对象的区别。 7.3.1.1 自由溶液区带芯片电泳 自由溶液区带电泳是在开管通道中直接利用物质的质荷比差异实现分离的一种电泳模式,它也是各种电泳分离中最基本的一种,影响因素相对较少,容易在芯片上实现。 作者实验室在介入微流控芯片工作的早期,曾在自由溶液区带芯片电泳方面做了大量的研究工作,主要涉及糖和糖肽分离、氨基酸分离、手性分子拆分、相互作用的研究等。现将相关结果逐个予以介绍。 (1)单糖 在微流控芯片上实现了单糖的快速分离(图7-6),并对芯片电泳的分离效率以及定量结果等做了考察,为糖的分离和检测提供了一种快速有效的平台[4]。
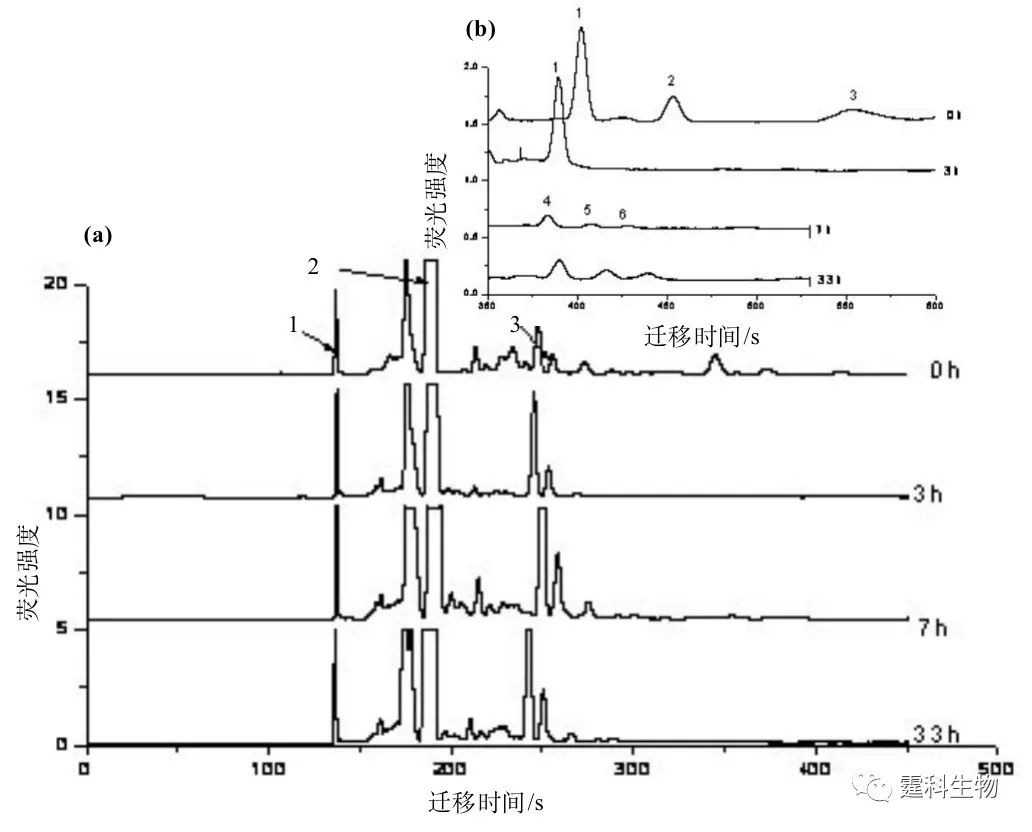
图7-6 四种单糖在50 mM硼砂运行缓冲液中直接检测的芯片电泳图[4] 注:1.鼠李糖;2.木糖;3.葡萄糖和甘露糖;4.半乳糖 (2)糖肽 令芯片电泳与外切糖苷酶酶解结合建立了糖蛋白的酶水解产物中糖肽的分析方法[5]。糖蛋白经链霉蛋白酶充分水解,用截流分子量为1000 Da透析膜除掉小分子量肽段或者氨基酸后得到一些大肽以及糖肽的混合物。对该混合物进行外切糖苷酶(α-甘露糖苷酶和β-乙酰氨基葡萄糖酶)酶解,对酶解前后的混合物作芯片电泳分离(图7-7)。根据酶解前后混合物的电泳谱图变化判断糖蛋白所含糖链的结构类型。
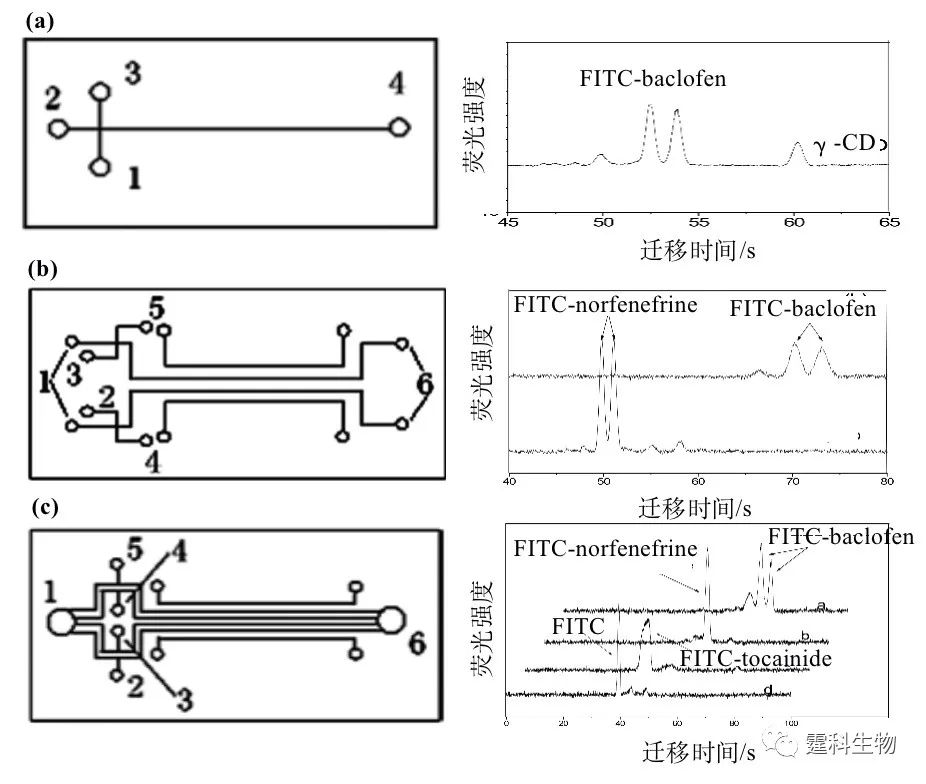
图7-7 糖肽的芯片电泳图谱[4] (a) 火鸡卵白蛋白的糖肽以及糖肽经α-甘露糖苷酶酶解不同时间的完全芯片电泳图谱,1.内标,2.TAMRA的水解产物,3.TAMRA(一种用于糖肽标记的荧光染料);(b) 迁移时间从350 s到600 s的芯片电泳谱图的放大图,从图中可以看出峰2和3在经过3 h的酶解后消失,经过7 h酶解后有新的峰(4、5)出现,而此后不再发生变化。从这一点可以看出火鸡卵白蛋白的糖链含有外连接的甘露糖,即火鸡卵白蛋白含高甘露糖型或者杂合型的糖链。分离缓冲液:20mM硼酸盐缓冲液(pH 8.6)+1 mM乙二胺 (3)手性拆分 利用自行研制的激光诱导荧光阵列检测器实现了由单通道到多通道微流控芯片上的手性拆分(图7-8)。用七种中性环糊精(CD)类拆分剂对三种经荧光染料FITC标记的碱性药物的拆分性能进行考察[6]。
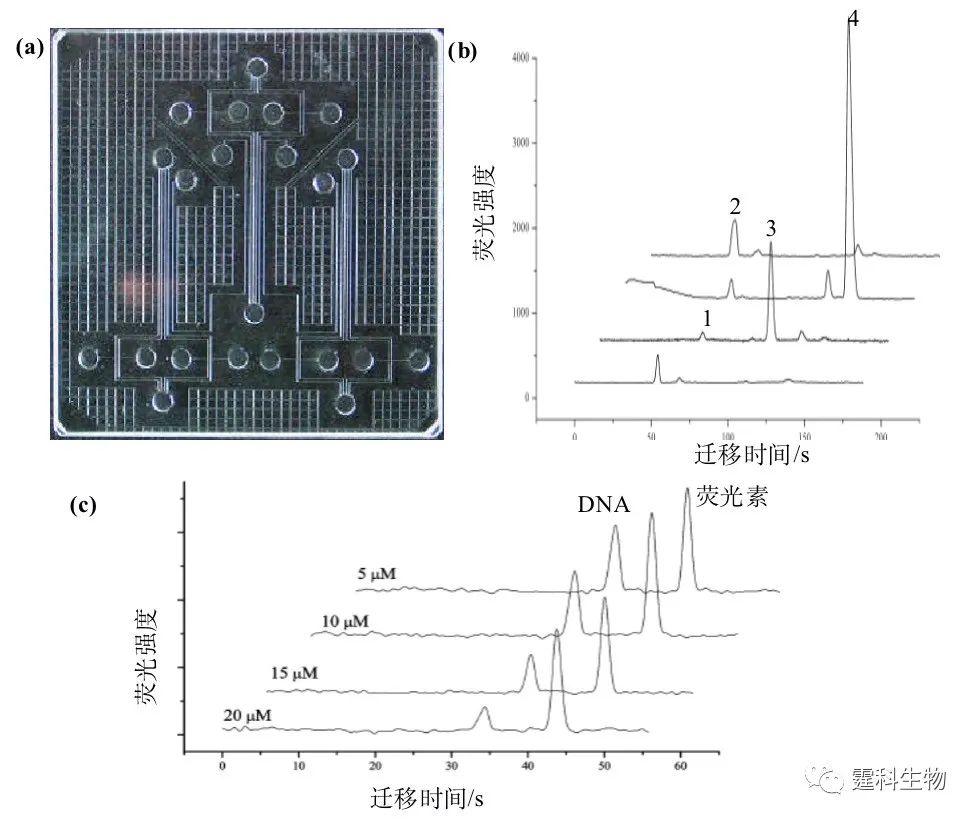
图7-8 单通道-多通道芯片结构示意图及芯片手性拆分电泳图[6] 首先进行对映体在单通道芯片上的拆分,发现七种中性环糊精中有三种对拆分FITC-baclofen有效,两种对拆分FITC-norfenefrine有效;接着利用筛选出的拆分剂在双通道芯片上分别拆分FITC-baclofen和FITC-norfenefrine;最后实现对映体在四通道芯片上的拆分。 (4)氨基酸分离 自行设计的四通道微流控芯片具有四个独立的进样和分离单元,可以同时快速分析测试四个不同的样品,见图7-9(a)。考察了荧光标记的人血清白蛋白在各个通道多次上样分析的重复性,分离了4种FITC标记的氨基酸[7],见图7-9(b)。FITC标记的氨基酸分别放置在不同的样品池,同时进样分离。因为在标记过程采用10:1 的氨基酸-染料比,染料基本被反应完毕,谱图中染料峰很小。 (5)分子相互作用 利用自行研制的阵列微流控芯片系统定量评价寡聚双链DNA-纺锤菌素的相互作用[8]。利用阵列微流控芯片电泳技术,四个不同的样品可以在50 s内同时分离,快速简便计算得到结合常数和结合计量比。 芯片通道采用聚丙烯酰胺涂层以抑制电渗流和DNA吸附,将荧光标记的双链DNA和纺锤菌素以不同浓度比例配制成系列浓度样品,并加入10.0 μM荧光素作为内标物进行平行多通道电泳分离。可以看出随着纺锤菌素浓度比例的增加,内标物荧光素钠的峰高峰面积没有明显变化,自有双链 DNA 的峰高峰面积逐渐下降,说明双链DNA和纺锤菌素有结合发生,见图7-9(c)。
图7-9 阵列微流控芯片实物图(a)和四种氨基酸芯片电泳谱图(b)及DNA与不同浓度纺锤菌素相互作用的多通道平行分析谱图(c)[7, 8] (b) 1.FITC-赖氨酸;2.FITC-精氨酸;3.FITC-苯丙氨酸;4.FITC-甘氨酸 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |