|
|
图解微流控|第13期发表时间:2021-10-12 14:37 进样和样品预处理技术(二) 5.2 气/固态样品进样 芯片实验室因其集成各种单元技术的本质属性而被认为有望实现常规的生物或化学实验室的各种功能,原则上它应当能够处理常规实验室可处理的气固样品,虽然目前尚不是主流。此处将各举一例,分别对气体和固体样品的进样予以简略说明。 气体是无固定体积的流体,不能存储在芯片储液池内,只能由外部导管引入芯片。气体进样要求导管与芯片间接口的气密性好。对于气体辅助的芯片细胞处理[17],要求气压较低以免细胞破损,此时将输气导管直接插入PDMS芯片的储液池,仅PDMS的弹性便足以密封整个接口(图5-13(a))。 固体本身不具有流动性,但在粉末化后可以被引入芯片进行处理[18](图5-13(b)和(c))。芯片粉末处理技术在粉末状药物的筛选中有一定应用潜力。
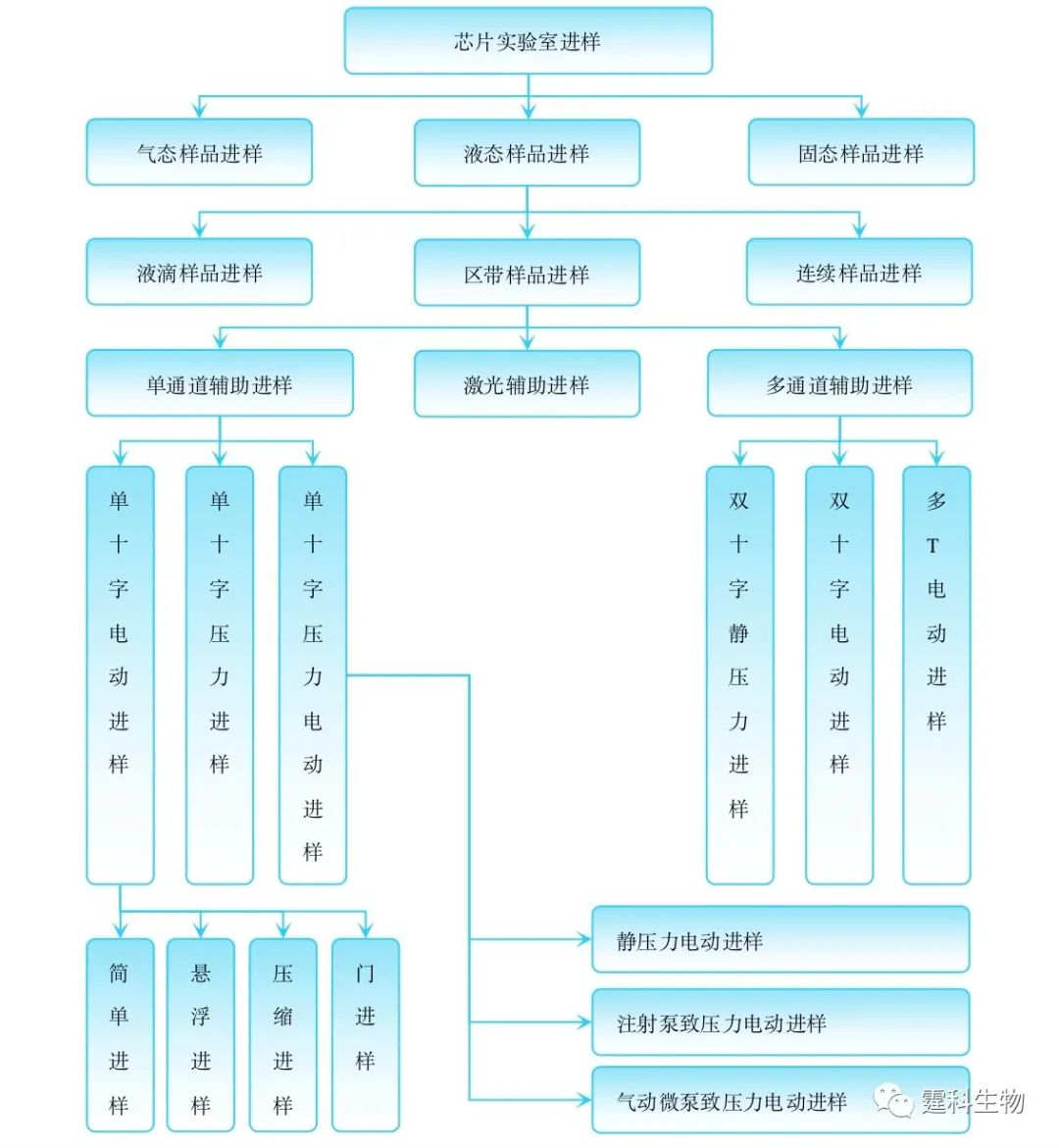
图5-13 气固态样品进样概念展示 (a) 一种PDMS芯片上的气体进样装置;(b) 固体粉末进样器设计;(c) 在T型交叉口拍摄的固体粉末进样全程照片,A-D,上样 (粉末在重力作用下进入交叉口);E、F,取样 (交叉口样品被气流引入样品处理通道) 5.3 芯片实验室各种进样方式一览 进样是芯片实验室的一个重要单元操作,也是芯片实验室样品处理的前道工序。对进样的研究主要集中在液态区带样品进样上。多种进样方法的陆续提出不但为后续样品处理提供了有力的支撑,还丰富了芯片实验室概念的外延,促进了芯片实验室领域的发展。本章所涉及的各种进样方法的总体脉络如图5-14所示。
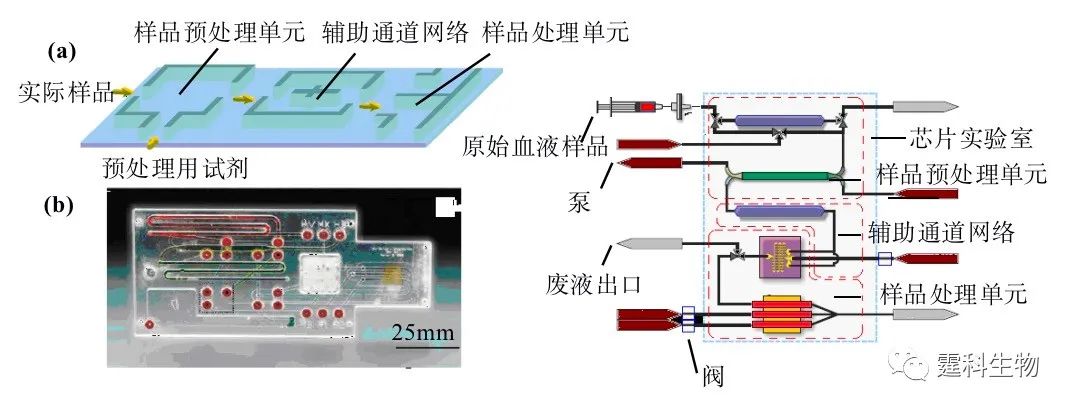
图5-14 各种芯片实验室进样方法一览 样品预处理 在常规操作中,样品往往先预行处理,然后再引入其他操作单元,常见的预处理操作有萃取、过滤、膜分离、等速电泳和场放大堆积等。将这些操作移植到芯片上完成可使芯片具有直接处理实际样品的能力,还会减小耗样量,这些都是芯片实验室实用化、产业化的必要条件。当然,这样一种移植将会使这些操作置于样品引入之后,但我们承袭传统,仍称其为样品预处理。 芯片样品预处理操作往往涉及多种试剂、多个步骤和复杂微通道网络(图5-15)。芯片样品预处理单元同时要与外部样品源和后续样品处理单元偶联。因此,芯片样品预处理技术含量高、操作难度大,但蕴含技术增长点也多,是当前芯片实验室研究的重要组成部分和持续热点之一。
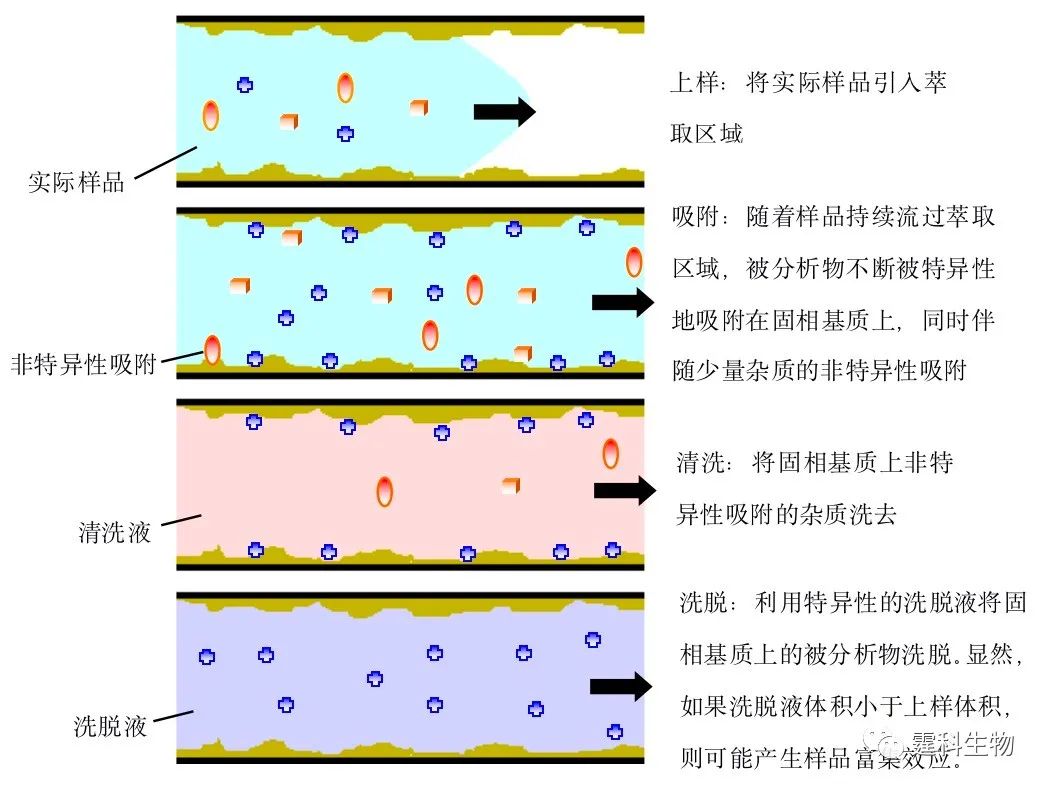
图5-15 芯片样品预处理概念展示 (a) 集成有样品预处理操作单元的芯片实验室结构示意 (实际样品和预处理用试剂以连续进样方式(5.1.3)被引入样品预处理单元,处理后的样品经过一个辅助通道网络后以区带、液滴或连续流的形式进入样品处理单元进行处理);(b) 一种集成有样品预处理操作单元的诊断用微流控芯片实验室(实物照片和结构示意)[19],该芯片可直接处理原始血样 5.4 萃取 萃取(extraction)是利用物质在两相中保留行为的不同对该物质进行提取的一种样品预处理方法。如果两相为互不相溶的两种液相,这种萃取就为液液萃取(liquid-liquid extraction);如果两相分别为固相和液相,则被称为固相萃取(solid phase extraction, SPE)。 萃取,特别是固相萃取,可很容易地将被分析物从复杂基质中提取出来,提高后续分析的可靠性,同时还可对样品进行富集,降低微流控芯片对高灵敏度检测器的依赖。很多芯片样品预处理研究都围绕萃取技术展开。 5.4.1 固相萃取 5.4.1.1 基本原理 芯片固相萃取的富集效应可由公式F=pVi/VF描述,F为富集倍数,p为相转移率,Vi和VF,为样品溶液和洗脱液的体积。相转移率指的是固定相表面对样品的吸附量占上样量的百分比。芯片固相萃取原理如图5-16所示。
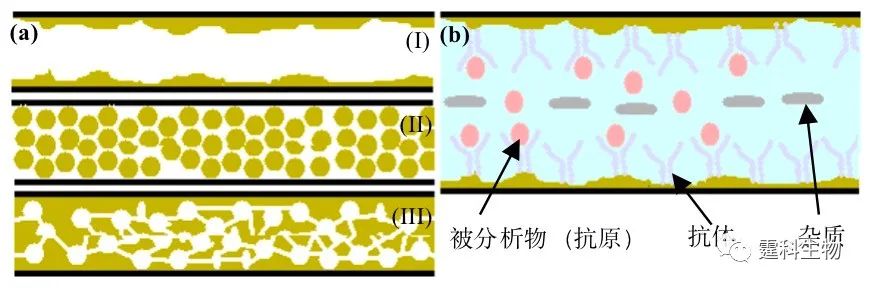
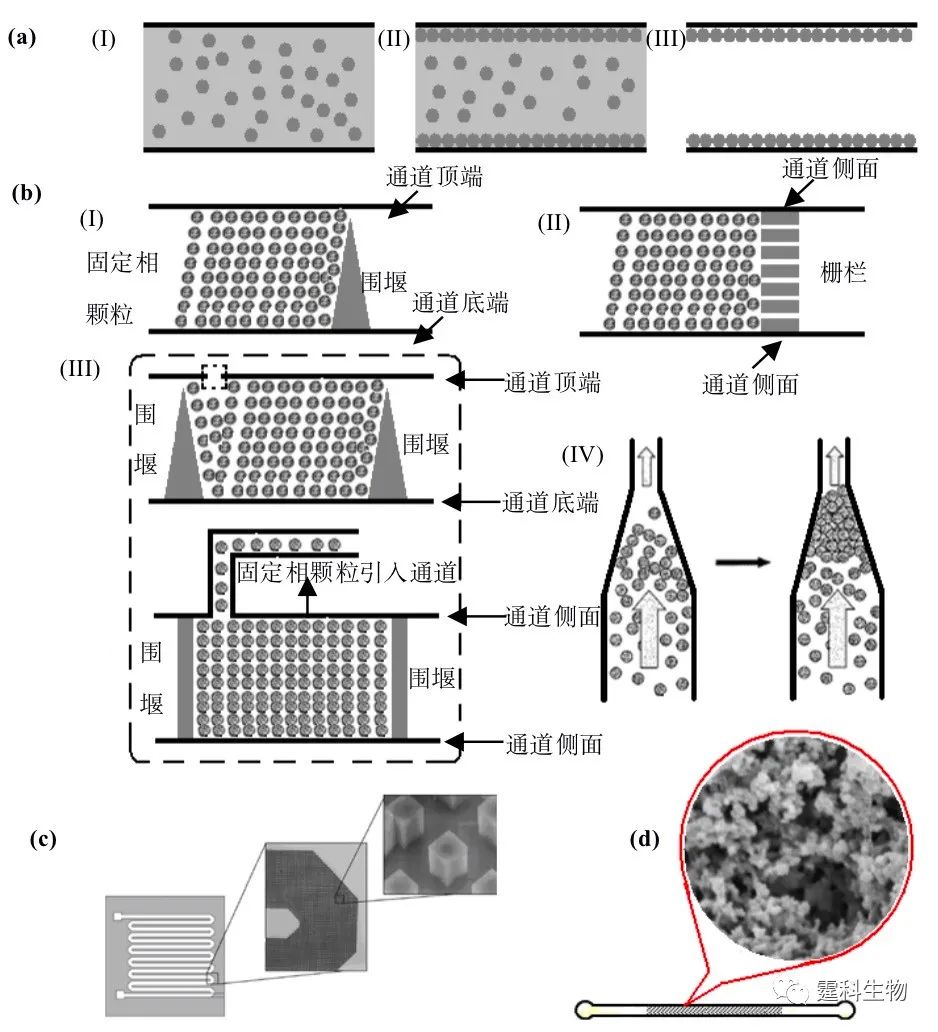
图5-16 芯片固相萃取原理示意 5.4.1.2 固定相 固定相是芯片固相萃取的核心元素,在样品确定的情况下,它决定着萃取的效率和富集的倍率。一般而言,固定相比表面积越大,吸附被分析物的特异性越强,萃取效率和富集倍率越高。 图5-17对芯片固相萃取柱的几种形式作了描述。开管柱为中空结构,柱压低,操作简易。填充柱和整体柱具有较大的比表面积,萃取效率和富集倍率可达很高(>103)。在这三种不同形式固定相的表面都可固载与被分析物有强特异性结合的配体,譬如针对被分析物的抗体(图5-17(b))。被分析物和配体之间的这种强特异性的结合可在很大程度上提高萃取效率和富集倍率,但要求配体能在实际样品和清洗液较长时间的浸泡下保持活性。
图5-17 芯片固相萃取固定相 (a) 三种不同的形式:(I)开管柱(固定相存在于通道壁),(II)填充柱 (固定相以微小颗粒的形式填充在通道中),(III)整体柱 (固定相以一种多孔固体的形式充满微通道);(b) 表面固定抗体的开管萃取柱 开管柱常用涂渍法制备(图5-18(a)),将溶有固定相的溶液注入通道,通过键合、交联或物理吸附(涂渍法)等方法将其中的固定相结合到内壁,最后去除残液,清洗管道。常见的固定相有聚硅氧烷和经硅烷偶联剂偶联的其他类型固定相[20]。 在填充柱中,固定相以微颗粒的形式充满微通道,制备过程分两步:即先在柱端形成固定微颗粒的塞子,再填充固定相颗粒。其中第一步是制备的关键。有别于常规的嵌入式植入,芯片中柱塞的制备通常采用原位加工技术,即在芯片制作过程中,通过微加工技术直接在微通道中的相应位置形成柱塞。理想的柱塞应为高强度、小流阻和强化学惰性。柱塞制备完成后,固定相颗粒在液流的带动下流过柱塞,被截留在微通道内形成填充柱。更新填充柱时,只需反向冲出填充微粒即可。 柱塞可为单围堰式[21]、栅栏式[22]、双围堰式[23,24]或楔石式[25](图5-18(b))。整体柱制备有两种方法:在微通道内直接加工形成的含有氧化硅涂层的方形微柱阵列(图5-18(c))[26]或原位合成多孔有机聚合物(图5-18(d))。
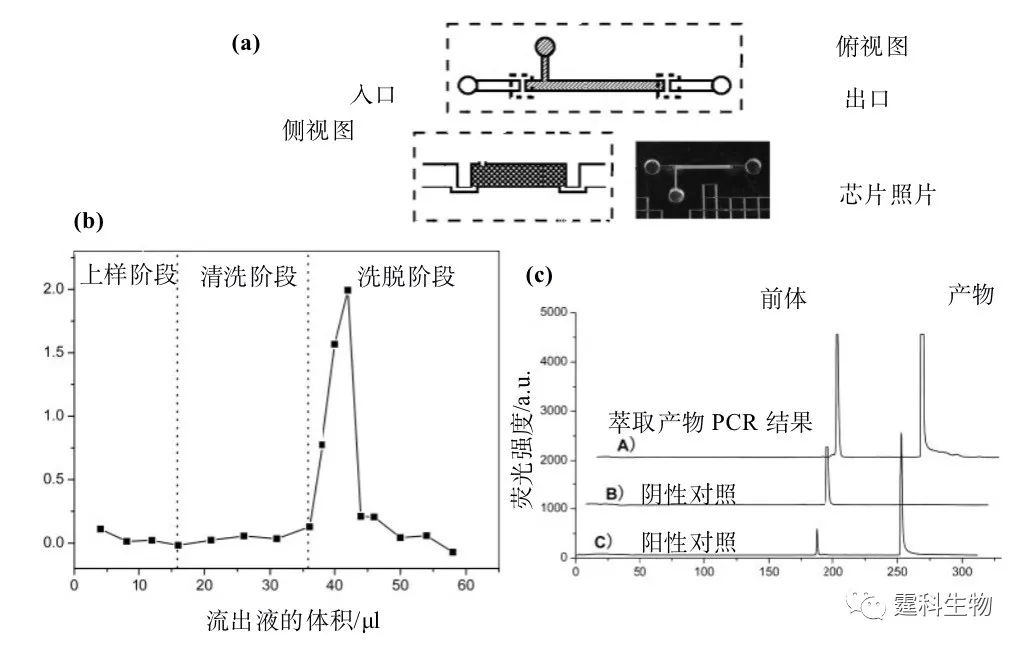
图5-18 芯片固相萃取固定相的制备 (a) 涂渍法制备开管柱原理示意,(I) 将溶有固定相的溶液注入通道,(II) 固定相通过键合、交联或物理吸附等手段结合到通道壁,(III) 去除残液,清洗管道,得到开管柱;(b) 四种不同形式的填充柱柱筛,(I) 单围堰式,(II) 栅栏式,(III) 双围堰式,(IV) 楔石式;(c) 微柱阵列型固相萃取柱;(d) 原位聚合型固相萃取柱[27] 5.4.1.3 在DNA提取中的应用 芯片固相萃取技术的一个重要应用领域为实际样品中DNA的分离和纯化。相对于超声波法、热法、介电电泳法等其他提纯方法而言,固相萃取法因操作简单、省时且DNA降解较少而逐渐引起人们的关注。若结合使用蛋白质变性剂和RNA降解试剂,可进一步提高DNA的纯度和产率,从而使该方法可应用于不同来源的样本。 一种常用的萃取固定相材料为氧化硅(SiOx)。相应的萃取过程为,使溶有高浓度盐的DNA样品溶液流过氧化硅表面,因高浓度的盐具有减弱静电排斥力,增强氢键结合力和脱水的作用,DNA分子会吸附在氧化硅的表面,随即用80%异丙醇溶液冲洗掉杂质,最后用小体积、低离子强度的溶液将DNA样品洗脱。基于此原理,白血细胞中的DNA可直接被回收。 回收时常用到GuHCl和1% 的非离子表面活性剂Triton X-100。GuHCl除提高缓冲液离子强度外,还有助于裂解细胞、变性蛋白质、抑制核酸酶的活性,防止DNA在纯化过程中发生裂解。Triton X-100能有效裂解细胞并从细胞核中释放DNA,还能增加脂类物质的溶解度以防止阻塞微通道。整个萃取过程用时小于10 min,回收率达70%,蛋白质去除率超过80%。如果使用吸附量为10~30 ng/mg的氧化硅树脂,从微升级的白血细胞、癌细胞、甚至全血中萃取的DNA可直接进行PCR扩增反应。 作者课题组利用氧化硅在芯片上建立了基于固相萃取的DNA提取方法(图5-19)。相对于超声波法、热法、介电电泳法等其他提取方法而言,该法操作比较简单、省时且DNA降解较少。
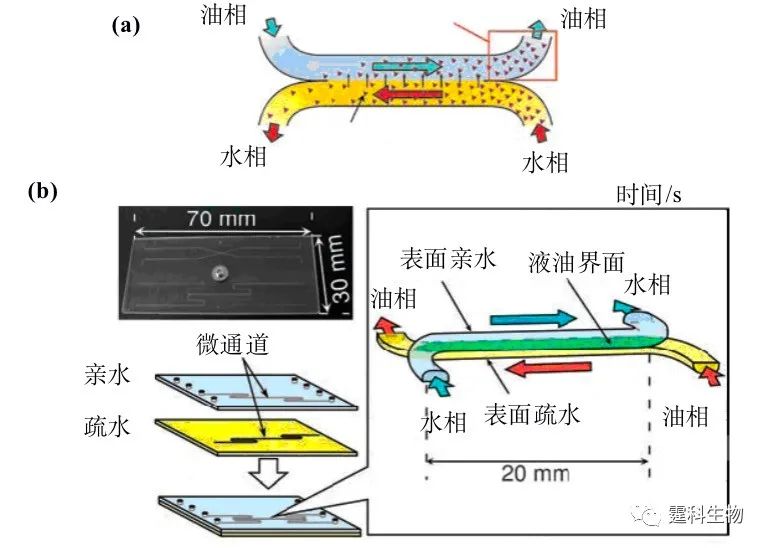
图5-19 芯片固相萃取在DNA提取中的应用 (a) 双围堰DNA萃取芯片设计;(b) 该芯片上λ-DNA在萃取柱出口端的流出曲线[23,24] (上样体积为16 μL,8 μL洗脱液可将85%吸附的λ-DNA洗脱);(c) 以萃取所得λ-DNA为模板的PCR产物的芯片电泳谱图[23,24],产物峰的出现证实了萃取所得λ-DNA的高纯度。萃取所得DNA的纯度是判定一个固相萃取柱能否用于提取实际样品中DNA的重要判据 5.4.2 液液萃取 液液萃取的目的是将被分析物从一种液体提取到另一种与之不相溶的液体中。实现这一目的有两个条件,两相间的充分接触和萃取完成后两相的完全分离。在微流控芯片上,通过两相在微通道内的“反向层流”(laminar countercurrent flow)可以同时实现上述两个条件,从而达到高效的液液萃取[28](图5-20)。
图5-20 芯片液液萃取 (a) 芯片“反向层流”液液萃取原理示意;(b) “反向层流”液液萃取芯片的实物照片和加工过程 (上层通道表面亲水,下层通道表面疏水,这种设计可以保证水相只在上层通道流动,油相只在下层通道流动) 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |