|
|
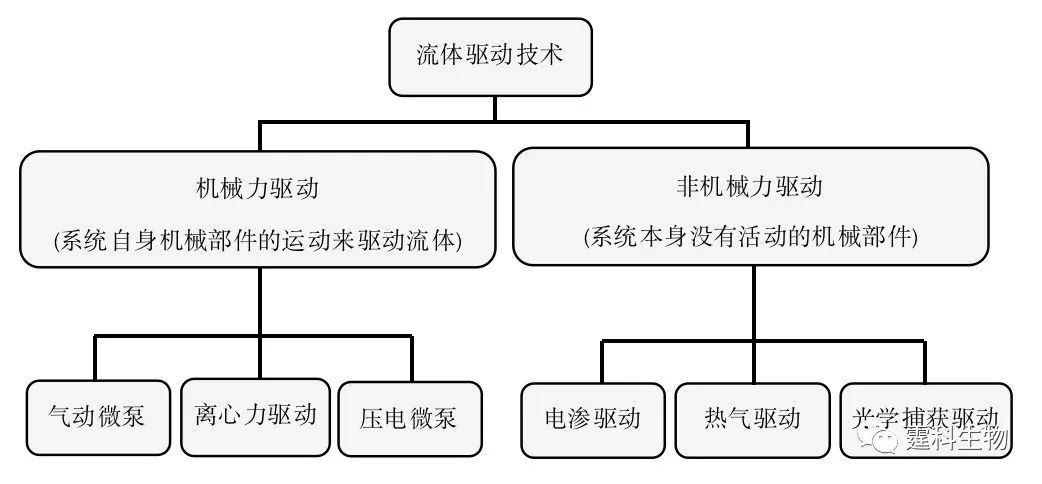
图解微流控|第10期发表时间:2021-09-24 13:30 微流体驱动与控制技术(一) 微流控芯片的基本要点之一就是对微尺度下的流体进行操作和控制,而作为操作和控制对象的流体量又极其微小,物质的很多表现形式和常量物质有所不同,因此要求有相应的微流体驱动与控制技术。 4.1 微流体驱动 在芯片实验室中,流体驱动方式一般可分为两类(图4-1):一类是机械驱动方式,包括气动微泵、压电微泵、往复式微泵等各种微泵驱动和离心力驱动,主要利用自身机械部件的运动来达到驱动流体的目的,驱动系统中包含能运动的机械部件;另一类是非机械驱动方式,包括电渗驱动、重力驱动等,其特点是系统本身没有活动的机械部件。
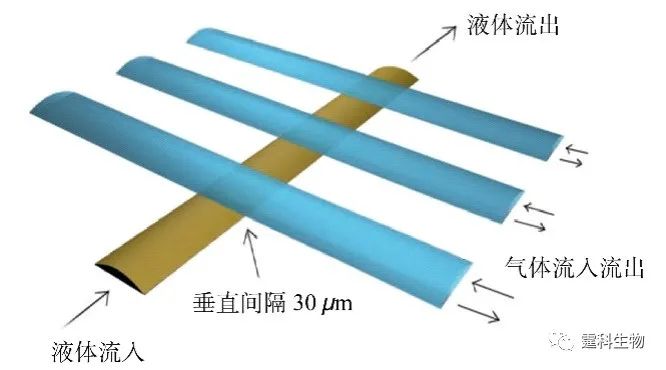
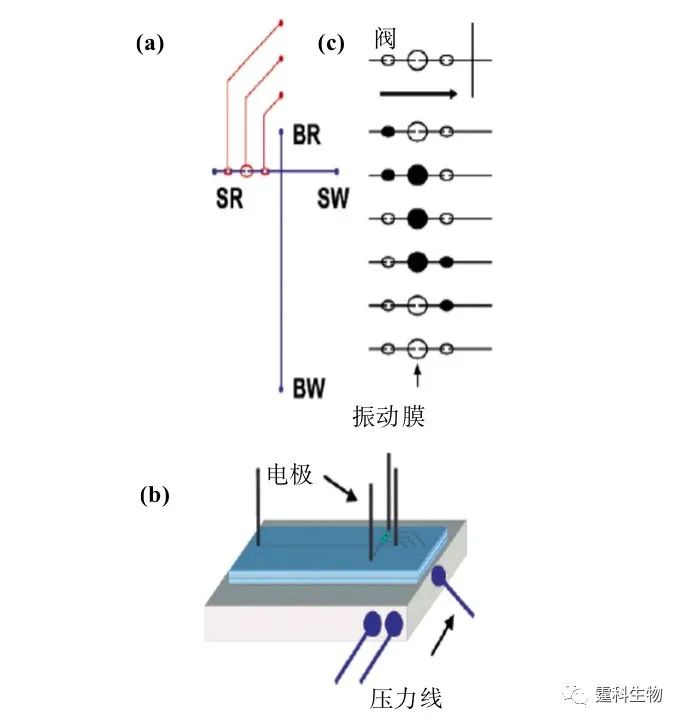
图4-1 流体驱动技术分类图 4.2 机械驱动 4.2.1 气动微泵驱动 4.2.1.1 PDMS气动微泵驱动 PDMS气动微泵芯片由纯PDMS材料制成,微泵部分由多个气动微阀构成,其结构如图4-2所示[1]。在常规状态下,阀门是敞开的。当施加动力时,PDMS薄膜在气体压力作用下发生形变,堵塞流体通道,阀闭合;撤销压力时,PDMS薄膜在自身弹力的作用下恢复原状,流体通道畅通,阀开启。顺序控制三个阀的开启、闭合动作,即能实现对微通道中液流的驱动。基于上述气动微泵的原理,Quake课题组设计了一种循环泵[2](图4-3)。循环泵可突破扩散限制,在样品混合和提高表面吸附灵敏度方面显示很好的应用前景。利用循环泵,能快速混合包括从小分子染料到1 µm磁珠在内多种样品。采用循环泵本身作为孵育室,进行生物素/亲和素结合分析,可得到比常规被动平衡吸附更高的样品结合效率(80%)和更短分析时间。他们采用这种微加工的循环泵,设计并制造了循环PCR微流控芯片[3]和血液DNA提取微流控芯片系统[4]。
图4-2 气动微泵结构示意图[4]
图4-3 PDMS微循环泵 上述研究人员[5]还在此基础上设计了一块大规模集成的芯片,如图4-4所示,其材料依旧为PDMS,共集成了3574个微阀和1000多个微泵,其集成的密度和数量都是相当惊人的。为今后微流控芯片的功能化大规模集成提供了一个很好的示例。
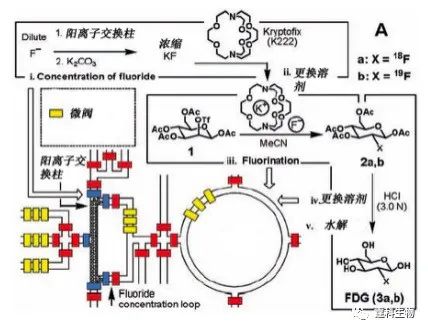
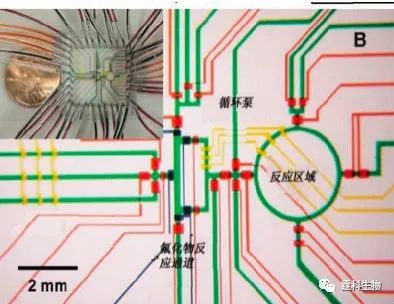
图4-4 微流控大规模集成芯片[5] 4.2.1.2 PDMS气动微泵驱动及应用 2005年,Quake[6]等把这种阀泵应用于一种昂贵的放射性标记成像探针的氟化物分子合成中,显示了反应迅速,效率高,节省成本等显著优势(图4-5,4-6)。
图4-5 放射性氟化物分子合成反应的芯片示意图[6]
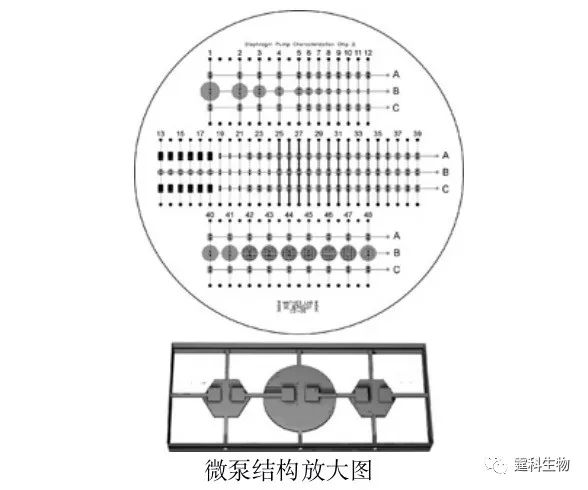
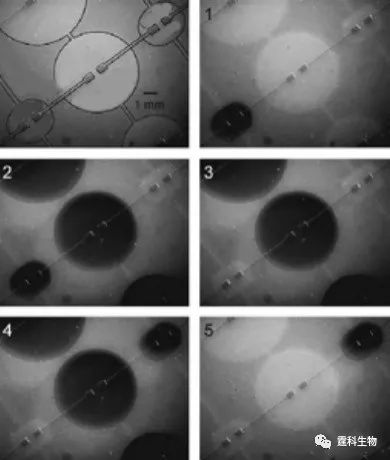
图4-6 用于合成氟化物的芯片实物图[6] 4.2.1.3 PDMS-玻璃杂交气动微泵驱动 上述实验中的芯片材料全部为PDMS,但PDMS为强疏水物质,对很多生物样品如蛋白,DNA,氨基酸等具有较强的吸附性,在使用上造成很大的局限性,而玻璃材质因为其良好的透光性、亲水性、表面性质稳定和生物学惰性等优点,和PDMS具有很强的互补性,同样在微流控芯片中被广泛采用。基于这种考虑,Mathies等提出了另一种气动微泵[7],这种微泵分为三层的玻璃-PDMS-玻璃和四层的玻璃-玻璃-PDMS-玻璃两种结构。该微泵也由三个微型阀构成,也能实现规模集成,与纯PDMS气动微泵不同的是,在通常状态下阀门是闭合的。图4-7是集成48个微泵的示意图,图4-8是这种微泵的实时工作示意图。
图4-7 集成微泵示意图[7]
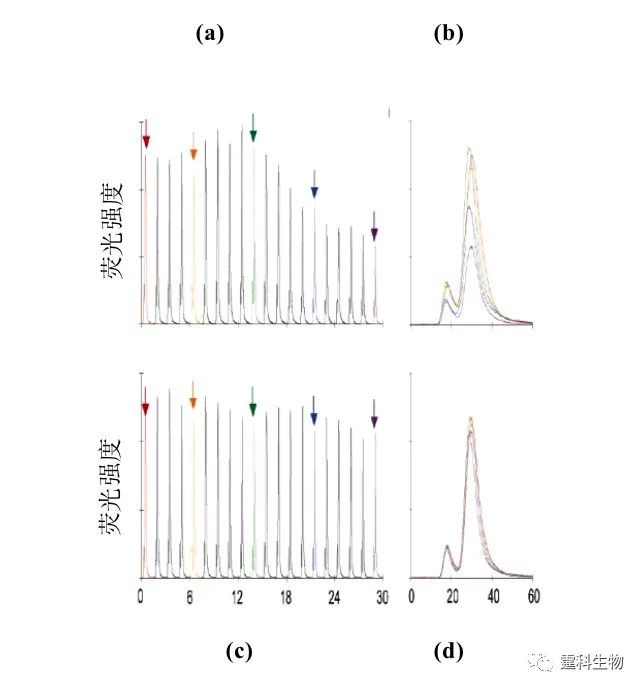
图4-8 微泵工作实时录像[7] 另有研究者将这种结构的PDMS-玻璃杂交芯片应用于芯片电泳中,在进样通道上集成了三个微阀作为进样泵(图4-9)。从图4-10可以看出,其进样的准确度和精度均优于电渗驱动[8]。
图4-9 芯片集成进样微泵[8] (a) 微泵结构示意图;(b) 微泵致动流程;(c) 芯片组装和压力集合
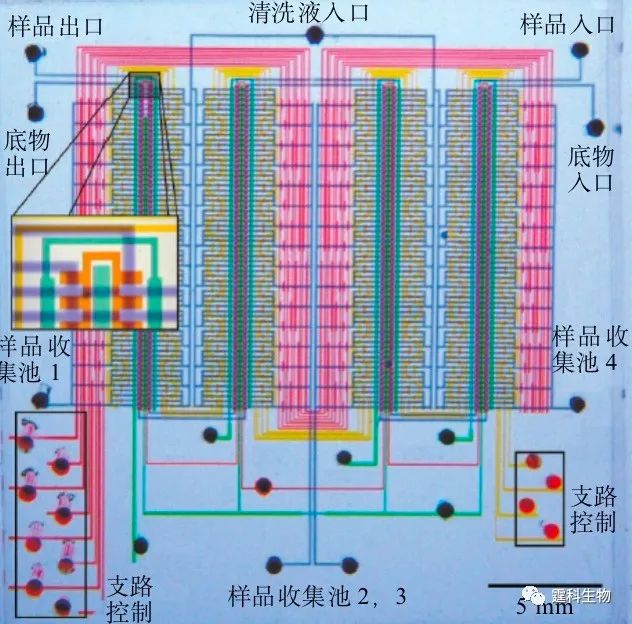
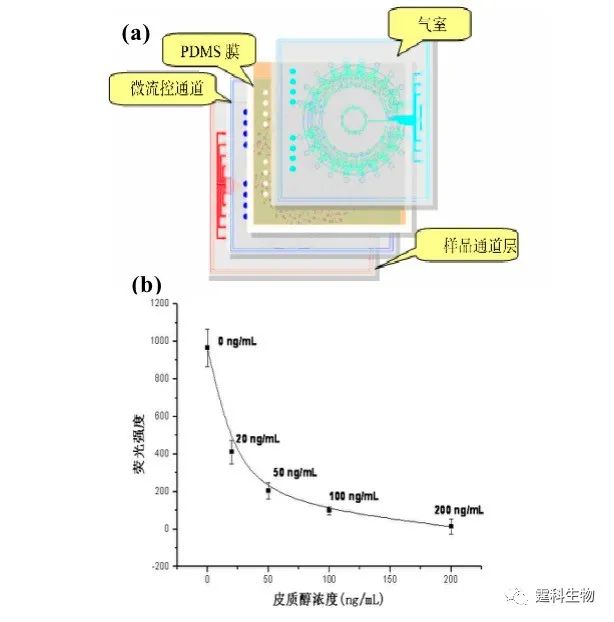
图4-10 连续分离FL和ROX 连续20次电渗进样(a)及电泳分离重现性(b)与连续20次微泵进样(c)及电泳分离重现性(d)比较图 4.2.1.4 PDMS-玻璃杂交气动微泵在酶联免疫中的应用 作者所在课题组利用上述微泵的原理,设计并制作了微泵驱动的酶联免疫微流控芯片,如图4-11(a)所示[9]。该芯片分为四层:第一层为气路控制层,由玻璃经光刻蚀刻制成,含有气室和气体通路;第二层为PDMS膜,厚度为254 µm;第三层为玻璃的微流体通道层,由光刻蚀刻的150 µm宽,30 µm深的微通道组成,混合,免疫反应,酶催化等均在此层进行;第四层为样品通道层,包含有反应所需的所有试剂,材料为PDMS。样品通道层与微流体通道层通过它们之间的微孔相连,借助微泵的控制,进行样品的混合反应然后泵入到检测通道中。整个免疫反应过程包括混合,竞争反应,洗涤,底物催化等,全过程均实现了自动操作。微芯片通道的高比表面大大缩短了整个过程的反应时间,使常规需进行几个小时的酶联免疫反应缩短到30 min。并在此芯片上进行了皮质醇标准曲线的测定(图4-11b)。
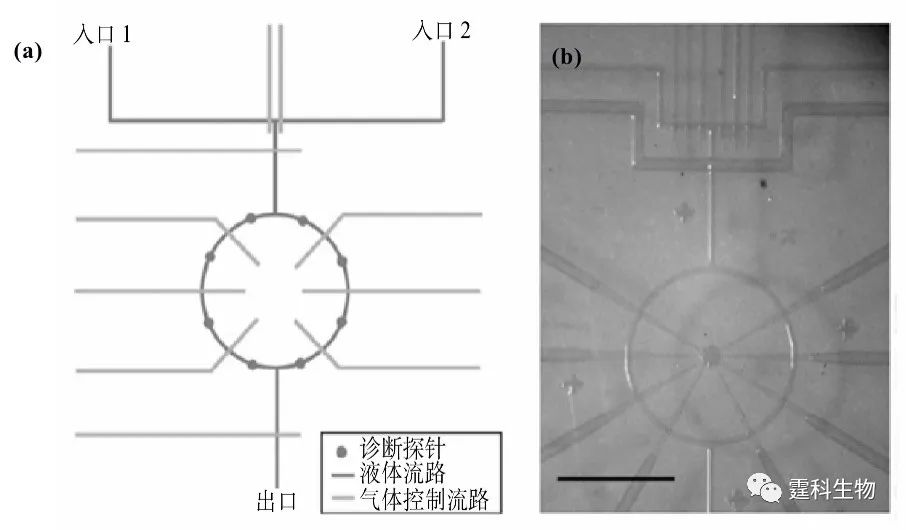
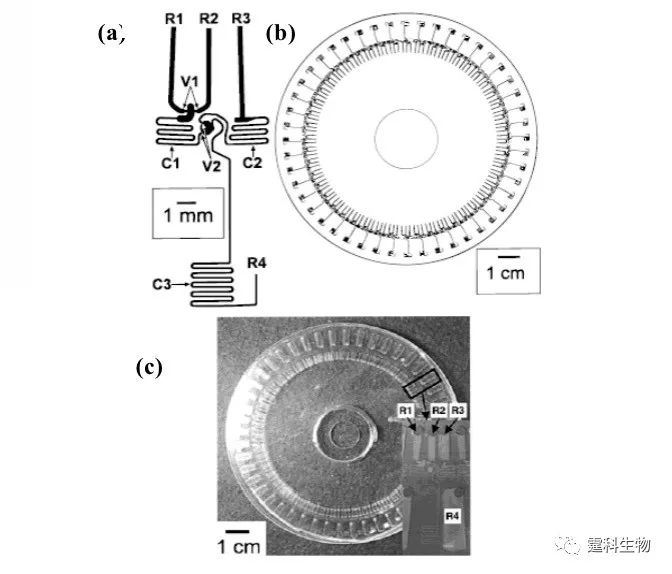
图4-11 全集成免疫微流控芯片示意图及其上的测定的皮质醇标准曲线[9] 4.2.2 离心力驱动 离心力驱动的特点是设备简单,流速稳定易调,单一电机即可驱动数十至数百个独立结构单元,非常有利于微流控芯片的高通量化。但由于运行过程中需要使芯片高速旋转,增加了液流控制及检测等方面的难度,因而难以大规模推广使用。 在离心力驱动中,微电机带动下芯片旋转所产生的离心力被用作芯片实验室中流体的驱动力。典型例子是Duffy等报道的一种集成了48个酶分析单元的离心力驱动微流控芯片[10] ,如图4-12示。整个芯片为圆盘形,48个酶分析单元阵列呈放射状排列。系统工作时,试剂放置于靠近圆心的储液池中,在芯片旋转所产生的离心力作用下流向芯片外周,依次完成酶分析所需的试剂混合、反应、检测等过程。
图4-12 离心力驱动的酶分析芯片[10] (a) 单个通道的芯片结构设计;(b) 48通道的结构示意图;(c) PDMS/PMMA 离心力驱动芯片实物图 4.2.3 压电微泵驱动 压电微泵是利用压电效应产生的形变作为流体的驱动源,它通常采用压电晶体和金属电极制作活动部件。其工作原理是压电隔膜在电压作用下,发生形变,使泵腔内的压力升高;撤除电压,压力降低。压电微泵通常由泵腔、一个单向进口阀和一个单向出口阀组成[11] ,泵腔压力升高,进口阀关闭,出口阀打开,泵腔里的液体经出口阀流出;当泵腔压力降低,进口阀开启,出口阀关闭,液体从进口阀吸入泵腔内,重复上述操作便可得到连续的液流。改变压电隔膜的振动频率可控制液流的流速和脉动特性。当前压电微泵流速最高可达2 mL/min,工作泵压高至17000 Pa。 Smits等采用三个压电致动器制成蠕动型压电微泵[12]。他们用阳离子异相刻蚀法在硅晶片上层刻出阀的位置,下层刻出微通道,然后用玻璃芯片进行阳离子封接。上层玻璃芯片阀的位置用压电晶片键合。其工作过程如图4-13所示,通过顺序激励三个压电盘可使微泵蠕动式运行,形成比较稳定的液流。在15 Hz的频率下,其最大流速能达到100 μL/min,最大泵压为60000 Pa。
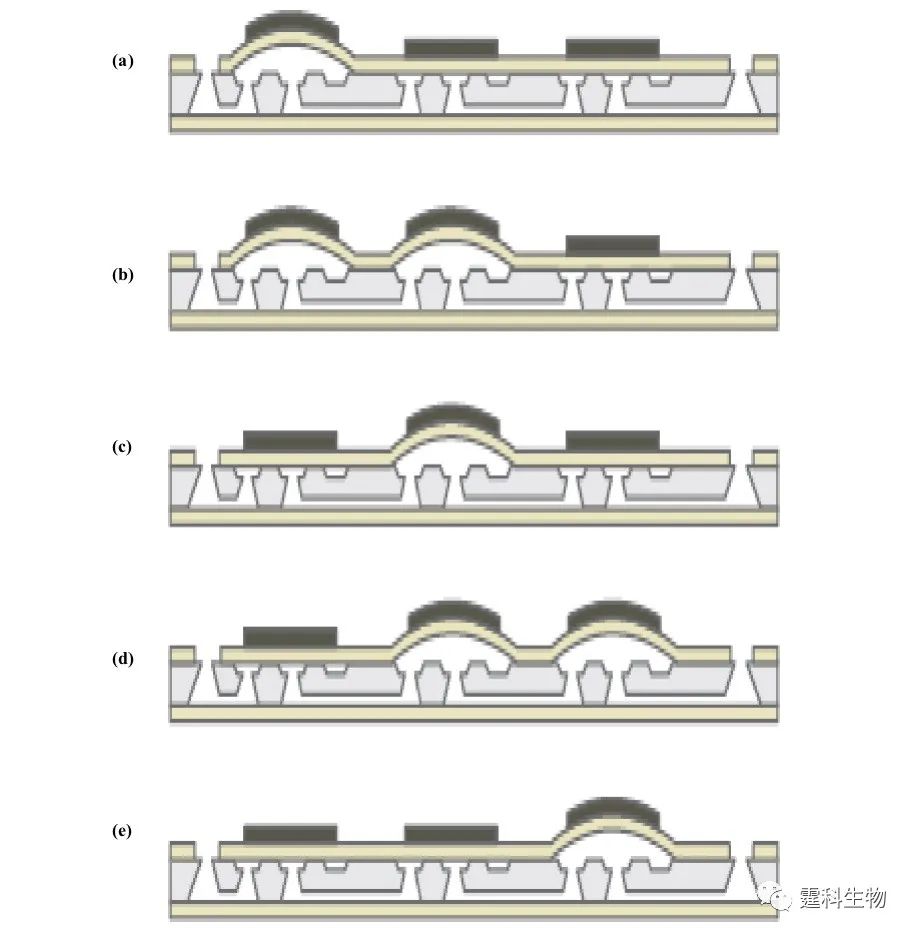
图4-13 压电蠕动微泵,通过程序控制压电制动器按照从(a)至(e)的顺序实现泵的运输[12] 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |