|
|
微流控芯片的战略机遇和我们的社会责任发表时间:2021-08-09 17:12 作者:林炳承 中国科学院大连化学物理研究所 摘要 本文为作者在第八次全国微流控芯片高端论坛(2020.11.26-28)上报告的书面文字版,整理过程中增添了论坛上部分嘉宾的报告内容。文章以作者所领导的实验室 20 余年来在微流控芯片领域的研究积累为基础,结合近年来这一颠覆性生物技术的蓬勃发展,围绕着微流控芯片三个方面的核心应用,阐述我们所面临的战略性机遇和应对策略。 2018 年 10 月 19 日 , 刘鹤副总理在答记者问时明确提出 ,“以生物技术和信息技术相结合为特征的新一轮科技革命和产业变革正在兴起,将会创造巨大需求”,微流控芯片是新一代“颠覆性”生物技术的突出代表 [1]。以微流控芯片为代表的新一代生物技术将会和信息技术结合,引发下一波科技革命,左右国家产业变革的战略布局 [2-3]。 一 . 微流控芯片的三个核心应用 [4-7] 应用反映需求 , 大量的研究和开发工作围绕着需求展开。微流控芯片有三个核心应用。其中之一是微流控检测分析芯片,这种芯片是新一代即时诊断(point of care testing, POCT)的主流技术,也是体外诊断(IVD)最重要的表现形式;二是微流控反应筛选芯片,微流控芯片还可被看成是迄今为止最重要的一种微反应器,它以液滴为主要特征,在高通量药物筛选 , 材料合成和单细胞测序等领域有巨大的潜力,其中的数字液滴显示了和电子芯片深度对接的战略前景;三是微流控细胞 / 器官芯片,这类芯片是对哺乳动物细胞及其微环境进行操控最为重要技术平台,可望大规模替代小白鼠等模型动物 , 用于验证候选药物 , 开展药物毒理和药理作用研究, 实现个体化治疗。下面,将对这三个方面的应用逐一予以阐述。 二 . 即时诊断 1. 即时诊断现状 即时诊断(POCT)是体外诊断的重要组成部分。微流控芯片是即时诊断的主要实现平台,微流控芯片通过即时诊断的方式实现体外诊断。在中国,微流控与体外诊断的绑定从政策层面得到了确认,现阶段 , 国内有近 90% 的微流控芯片公司都从事体外诊断产品的开发。即时诊断的第一轮工作大多集中于以核酸分 析为代表的分子诊断,以蛋白质分析为代表的免疫诊断和以代谢物分析为代表的生化诊断。当然, 还有一些其他方面的工作,如血液诊断,微生物诊断等。在2020 年 11 月 400 名代表参加的第八届微流控芯片高端论坛上,有多达 40 余个企业参展【图1】,而 2018 年被 Yole 报告列出的中国微流控芯片公司的数目仅为 25 家。Yole 分析师最新数据统计显示,2019 年全球微流控试剂产品市场规模达到 99.8 亿美元,相应的微流控设备市场为 34.8 亿美元,2019 至 2024 年期间的微流控产品市场复合年增长率高达 11.7%,微流控设备市场复合年增长率为 10.8%,预计到2024 年,两类产品的市场将分别达到 173.8 亿美元和 58.1 亿美元 [8]。在我国,2018 年体外诊断市场约 600 多亿人民币, 而 POCT(非血糖)市场约为 100 亿。  ▲【图一】部分国产 POCT 产品 2. 第二波 POCT 技术 值得关注的是第二波 POCT 技术。一般认为,第二波POCT 技术的应用对象主要为单细胞分析,液体活捡,肿瘤早期诊断和抗药性试验等,而医生办公室用 DNA 测序,家用基因诊断以及以安全有效使用药品和生物制品为特征的随行诊断等也可能是第二波 POCT 技术的关注对象。从平台角度看,主要会包括 POCT 整机和 5G 等信息技术的联用,以及POCT 设备内部和电子技术的结合。 单细胞分析已成为下一波即时诊断技术的重要对象。近年的很多证据表明,细胞群体,即使是很小的群体,都有很大的异质性,这和长期以来认为的细胞群体同一性观点背离, 实际上,现行基于细胞同质性的基因表达测定所得的只是一种统计平均,它没有考虑单个细胞之间很小但是很重要的差异,带有误导性。单个细胞之间在大小,蛋白水平,表达RNA 的转录等方面有显著差别,而这些差别往往是肿瘤研究, 干细胞生物学,免疫学,发育生物学和神经学中很多长期困惑人们的问题的关键所在。当细胞被用作药物时,则更为突出。 陆瑶等从活的单细胞中捡测到 42 种不同的蛋白质,创当时文献的最高捡测记录 [9]。所开发的单细胞蛋白分析技术获美国发明专利授权,并由美国 Isoplexis 公司进行后续开发, 产品在 2017 年年底获选美国科学家杂志(The Scientist) 当年度十大医疗技术发明第一名 [10]。这套系统能够同时捕获成千上万个单细胞的完整生物分子和功能信息, 能够更好地分析癌症患者对免疫疗法的治疗反应,提早预测包括细胞免疫疗法在内的抗癌免疫疗效。杨朝勇等则以核酸适体的高效筛选为基础,实现了单细胞的精准捕获与测序 [11]。 从平台角度看 , 关一民等提出的智能微流控反映了生物技术和信息技术结合的一种趋势。他们利用整晶圆集成 CMOS 前端与微流体 MEMS 后端,制备低成本智能微流体 CMOS- MEMS 芯片,实现对微量液体的自主,精准操作及控制。他们已经研制出一种用于黄曲霉素快速检测的 POCT 系统 , 并开始扩大到 3D 生物打印,医疗检测及精准用药等方面 [12]。 微流控数字液滴可以被看成是 POCT 设备内部和电子技术的结合范例。基于电润湿原理,在二维平面上运动的微流控数字液滴技术因其操控灵活,形状可变,大小均一,又有优良的传热传质性能,已经被应用于需大量使用微反应技术的现代生物化学分析领域。值得一提的是,数字液滴可能因为其所具备的和电子芯片深度对接的能力而在第二波 POCT 中备受重视。在电场作用下,液滴在电介质表面的表面张力减小,因此接触角变小, 液滴从未润湿变为润湿,这种表面张力的改变引发液滴受力不平衡,从而驱动液滴运动。可被视作为粒子的液滴一经带电,成熟的电子技术就可以源源不断的进入微流控领域,比如有源矩阵技术。有源矩阵技术是一种在电子行业常用的开关技术,通过与微流控数字液滴技术的结合,薄膜晶体管对行列交汇处的控制电极施加驱动电压, 实现液滴移动的自动控制,有源矩阵技术能并行控制超大规模液滴阵列,比如,对于M 行N 列的阵列,利用有源矩阵技术可使所需电极数由原来的 M*N 剧减为 M+N,克服过多的电极引脚造成的空间缺失,全自动完成复杂和庞大样品前处理任务。南方科技大学程鑫和中科院大连化物所陆瑶,刘显明等合作,承担题为“微流控数字液滴中央处理仪器的研制与应用”的国家自然科学基金重大仪器项目,旨在通过微流控数字液滴中央处理仪器和大规模有源矩阵数字微流控液滴芯片的研制,实现微流控技术和电子技术的深度对接 [13]。 蒋兴宇等把液态金属和用弹性高分子微流控芯片整合成柔性电子电路后,发现这些柔性电子电路可以在生物医学传感,组织工程,人用器官以及生物计算领域发挥非常大的作用。他们用液态金属和弹性高分子微流控结合 , 制备全柔性血氧传感器,全柔性汗液检测装置,电子血管和功能强大的血管支架 [14]。柔性材料还可制备可穿戴设备。Nature 曾报道一种集成模式,可以对人体体温及汗液中四种生化指标(葡萄糖, 乳酸,钾离子,纳离子)进行连续的定量检测的装置,还可通过多元检测得到不同检数据之间的相互矫正,从而提高检测结果准确性。在此基础上 , 刘宏等发展了相应的可穿戴生化传感技术。他们提出一种新的生物传感思路,研究出基于电解水辅助的电催化反应,发展了相应的无酶葡萄糖传感方法, 解决了无酶传感中的 pH 问题,实现了无酶的葡萄糖检测, 再将该传感器与智能手环,运动头巾等结合,用于监测汗液中葡萄糖的含量,寻求汗液葡萄糖和血糖的关係 [15]。 三 .材料的可控合成和筛选 这里所指的合成和筛选材料是微尺度的, 微尺度材料合成技术也被称之为微化工技术,它的基础是被视为最小微反应器的液滴。微化工技术因其混合速度快,传递性能好,以及反应条件均一可控,已成为化工学科的前沿方向之一,也是工程前沿和材料化学精准制备的新技术。 微化工产业用的芯片兼具高精度的微观特征尺度和较大的宏观器件尺寸 , 并具有无法通过传统平面光刻实现的三维构型。程亚等利用超快激光微加工技术制造微化工芯片 , 开拓了这种芯片在微化工产业中的应用 [16]。对液滴技术的研究则更为广泛。方群等发展了一种基于序控液滴阵列技术的微流控液滴操控新方法(SODA), 能自动完成对超微量液滴的生成, 融合 , 分裂 , 定位 , 迁移和分选等 ,SODA 技术具有微量自动 , 操控灵活 , 通用性强 , 应用面广等特点 , 适合于超微量样品和试剂消耗下多种类 , 大规模的分析和筛选 [17]。林金明等致力于和质谱的联用 [18]。姜洪源等则提出利用低压交流电场实现双乳内核融合 , 释放等精准操控的新方法 [19]。 以微流控芯片为平台,以分散的液滴单元作为微反应器, 通过制备相对简单的微球 , 比如氧化物,可以打通芯片合成材料的技术路线。微流控技术能够精确控制微量流体的运动速度并进而控制物质传递和反应条件,因此在制备纳米颗粒及微米颗粒时,不仅可以灵活调节颗粒大小、组成、结构(单分散性、壳层厚度,以及其它内部结构)、形貌、分布以及其他物理化学性质,还可以通过微颗粒结构和构成微颗粒的各组分的灵活结合以赋予其更加多样化的功能,从而为新型微颗粒型功能材料的设计和研制提供新的思路和途径。骆广生等把液滴用于微尺度材料合成,专门研究“微尺度流动与材料的可控制造”,并对高端材料化学品予以特别关注 [20]。某种意义上说 , 药物也是材料。液滴微流控芯片也被广泛用于药物的筛选,比如工业酶。用紫外光照射可产生全基因变性的酵母细胞库,将其和荧光酶底物一起包进液滴,被包进液滴的酵母细胞产生酶,消化底物,因此增加液滴的荧光,在孵化后,将液滴按它们荧光强度的不同分开,这类方法试剂消耗量小(μl 级),筛选速度快(1000 倍),费用还低(100 万分之一)[21]。 四 . 器官芯片 药物研究的一个重要环节是临床前动物实验,临床前动物实验的弊端包括:化费极大,耗时极长,存在动物权、动物伦理等问题,最根本的是 , 动物到底不是人 , 因此 , 结果往往不准。一个典型案例是 , 2016 年 , 法国科学家研发的一种已经完成动物试验的神经退行性药物,开始进行一期临床试验,六名健康志愿者中有一名脑死亡,四名病危,法国朝野震惊 [22]。药企的一个重要观点是 , 他们也并不看好动物试验 , 但是, 他们没有更好的办法。器官芯片的发展提供了一种可能的替代途径。 1. 器官芯片 已经有很多课题组开展单一或多种器官芯片的研究。林洪丽等构建不同的肾脏芯片用于研究各种不同肾脏病的发生发展机制。比如,高血压肾的损害是促进慢性肾脏病进展至终末期肾脏病的原因之一,他们将肾小球内皮细胞,肾小球基底膜与足细胞共同培养于流体小室中,构建了具有滤过功能的“肾小球”芯片,在这样的模型上,发现高流量灌注会损伤滤过屏障功能,並引起肾小球内皮细胞与足细胞的损伤 [23]。王琪等构建了肺癌脑转移多器官仿生模型 , 该模型由上游仿生肺及下游以血脑屏障为核心结构的仿生脑组成 , 再现上游肿瘤细胞侵袭进入循环到达下游靶器官 , 突破血脑屏障,进一步形成脑转移的病理全过程 , 实现了对复杂病理过程的可视化检测 [24]【图 2】。张秀莉,罗勇等构建了肝 , 肾和心脏芯片并成功地把它们作为药物毒效学评价平台 [25]。赵远锦等利用微流控技术制备了一系列结构功能特异的生物材料 , 解决器官芯片构建所遇到的瓶颈问题 [26]。张炜佳等则构建了主动脉器官芯片 , 并实现了一些生物力学模拟 [27]。 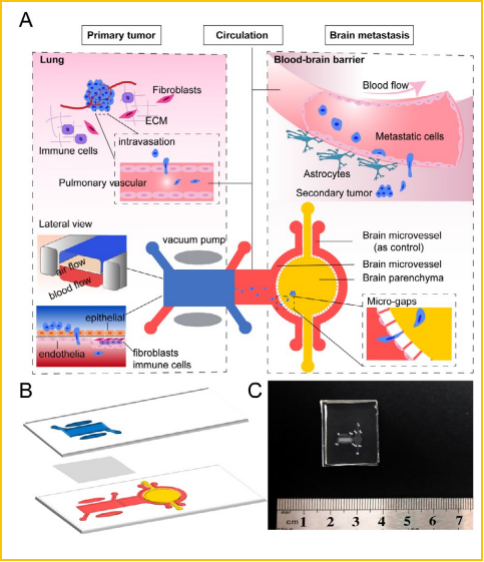 ▲【图二】肺肿瘤脑转移芯片示意 [24] 器官芯片是一种多通道,包含有可连续灌流腔室的三维细胞培养装置。器官芯片由两大部分组成,一是本体,由相应的细胞按实体器官中的比例和空间位置搭建;二是微环境, 包括芯片器官周边的其他细胞、细胞分泌物和物理力 [28]。比如, 肝脏主要包括肝实质细胞,星状细胞,枯否细胞和内皮细胞, 分别占比约 58.9%,17.6%,14.7% 和 6%,而内皮细胞和肝星状细胞是空间上紧邻的两种细胞,HepG2 细胞部分空间占比大,与其他三种细胞形成的颜色条带形式不尽相同, 其他三种细胞为线型或面型条带,HepG2 细胞则为三维条带。除了本体 , 还有微环境。陆瑶等用一种有 10 路平行通道的微流控芯片,连续测量 5000 多个单细胞在 4 个时间点的蛋白分泌物, 研究了人单个巨噬细胞对 Toll 样受体配体脂多糖(LPS) 的反应过程,揭示了不同蛋白在单个细胞中的四种不同的激活方式,并在相同的时间点对同一样本作单细胞 RNA 测序, 进一步证明了转录水平上存在两种主要的激活状态,分别用于翻译和炎症程序。结果表明,在一个表型均一的细胞群体中, 细胞内存在异质性反应 [29]。 还有更多的报道指出, 肠道微环境中很小的剪切力就能极化上皮细胞,形成折叠的绒毛,在肾近端肾小管芯片上,把单一的上皮细胞层暴露在流体剪切力的尖端,能改变上皮细胞的极性,导致离子的移位,形成初级纤毛,纤毛突的平均长度为 10±3.5μm [30]。 2. 器官芯片研究的下一波走势 普遍认为 , 器官芯片的下一波走势是:从器官芯片本体的构建到本体 + 微环境的仿生;从单一生理模型的构建到千变万化的类器官病理模型仿生;从单一细胞种植方法的发展到3D 打印细胞种植方法的全面介入,以及从单一器官的完善到多器官芯片系统甚至人体芯片的构建。整体而言 , 则是从以研究为主到研究开发生产并举。 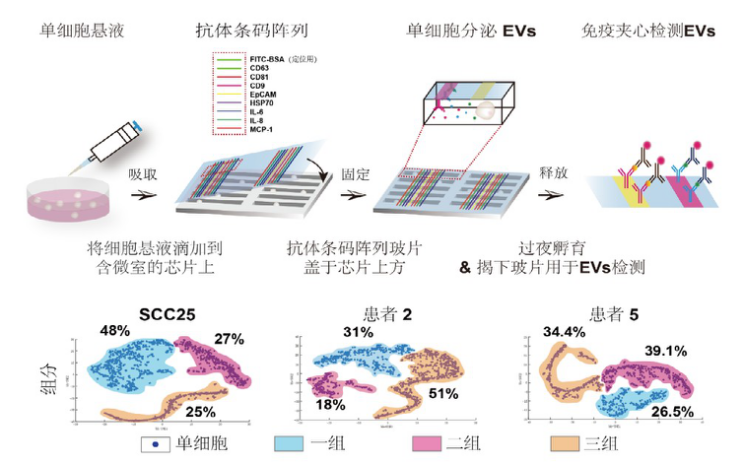 ▲【图三】高通量单细胞外囊泡的多指标分析 [31] 以单细胞胞外囊泡分泌物多路表征为例说明微环境的仿生。陆瑶 , 刘婷姣等把微芯片平台的两个功能部分用于单细胞胞外囊泡分泌物多路表征,一是有 6343 个鉴定单元的微孔阵列用于细胞培养,二是有一组平行微流通道阵列的玻璃抗体条形码用于单细胞囊泡的缚获和检测。这一高通量平台具有通过分泌的囊泡显示单细胞异质性的能力,【图 3】为单细胞外囊泡的多指标分析工作流程示意(上)并显示可视化聚类分析口腔鳞癌细胞系及肿瘤患者样本的功能亚群(下)[31]。在器官芯片中有一种值得注意的类器官技术,类器官是指在体外对干细胞进行诱导分化形成的在结构和功能上都类似于目标器官或组织的三维细胞复合体,具有稳定的遗传学特征,能在体外长期培养。把器官芯片技术与类器官技术结合, 形成类器官芯片技术。这样 , 通过使用患者的诱导多能干细胞(iPSCs)可在芯片上建立各种各样的类器官病理模型,并在体外模拟和重现。类器官芯片可以实现对药物药效和毒性进行更有效、更真实的检测,也可用于个体化治疗。由于类器官可以由人类 iPSCs 直接培养生成,相比于动物模型,会在很大程度上避免因动物和人类细胞间的差异而导致的检测结果不一致性 [32]。 3D 生物打印是对传统器官芯片细胞接种方式的一种革命。关一民团队研发了一种由 3D 生物打印机打印的肝芯片 , 他们先把细胞定量图案化接种,再用 24 个细胞培养杯在培养 板上形成 4 通道密封的流道结构,让细胞在培养杯定量成球培养,将培养板固定在生物打印机平台进行细胞打印,这样实现了用单细胞打印定量接种均一粒径的细胞团,进而打印器官的技术路线 [33]。还有一个比较著名的案例是 , 美国 Rice 大学团队提出一个 3D 打印的肺状系统,充满气蘘,可以扩张和收缩,具备肺通过向血液泵入氧气而发挥的生物功能。 “人体芯片”是一个基于干细胞技术,由器官芯片、仪器和软件组成人体仿真系统,为人体内部的生理和病理过程提供高仿真窗口的技术平台。“人体芯片”的研发过程是:在研制出一系列不同的单一器官及其微环境的基础上,引入液体处理机器人和移动显微镜,开发定制软件,把多重器官的芯片组合, 使多个器官芯片共置于一个标准的组织培养孵化器里进行自动化培养,灌注,介质添加,流体连接,样品收集和原位显微镜成像,并通过芯片对多器官人体灌注示踪剂(比如菊粉)的分布作定量预测,最终构建系统化,可灵活拆卸组装的“人体芯片”。“人体芯片”可为人类开展个体化治疗、药物筛选等提供仿真度极高,可靠性更好的技术平台,因此大幅度改善人类生存质量。这样的“人体芯片”应当是生物技术领域的“国之重器”。 微流控芯片正处于一个重要的发展阶段, 这一阶段的发展具有战略性。已经置身于其中的学术界, 产业界人士宜抓住机遇, 承担起我们的社会责任, 强化“学科交叉”,强化“全国范围内微流控芯片从业人员的协同创新”,贯徹 “以任务带学科” 的方针, 全面推动微流控芯片技术发展。 参考文献: 【1】 科技部《十三五生物技术创新专项规划》2017-05-18 【2】 林炳承,微流控芯片二十年,光辉的历程 (II), 中国科 学院大连化学物理研究所编 , P168-172,科学出版社 , 2019 【3】 林炳承,微流控芯片的研究与产业化,分析化学, 2016. 4., P. 491-499 【4】 林炳承,秦建华著 “微流控芯片实验室”,科学出版社, 390 页,2006; 【5】 林炳承,秦建华著 ,“图解微流控芯片实验室”,科 学出版社,475 页,2008; 【6】 林炳承著,“微纳流控芯片实验室”,科学出版社, 442 页,2013; 【7】 Bingcheng Lin editor:”Microfluidics: Technology and Application”,Springer,pp 344, 2013 【8】 Yole Report, 2019 【9】 Yao Lua et al,PNAS,Published online February 2, 2015,607–E615 【10】 The Scientist,2017.12 【11】 Chen, Y et al, J. Am. Chem. Soc., 2018, DOI: 10.1021/jacs.8b05429 【12】 关一民等 , 第八届中国微流控高端学术论薹文摘 , P.14,2020.11.26-28 【13】 程鑫,陆瑶,刘显明等国家自然科学基金重大仪器项 目“微流控数字液滴中央处理仪器的研制与应用”2019 【14】 Xing Yu Jiang et al, Science, 2018 年 6 月 14 日。 【15】刘宏, https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.201901370,2018 【16】 程 亚, 第 八 届 中 国 微 流 控 高 端 学 术 论 薹 文 摘 , P.17,2020.11.26-28 【17】 JW Wang et al,Anal. Chem. 2019,91,10132-10140 【18】 Z Wu et al, Angew. Chem. Int. Ed., 2020,59,2225- 2229 【19】 Jia, Y et al, Small, 2017, 13 (46), 1702188. 【20】 C. Shen , et al,Chemical Engineering Journal 259 (2015) 552-561. 【21】 Guo M T, Rotem A, Heyman J A, Weitz D A. Lab Chip, 2012, 12(12): 2146-2155 【22】 法新社,2016. 3. 16 【23】 Zhou M, et al. Sci. Rep., 2016, 6: 31771 【24】 Liu, W. et al,Acta Biomater. 91, 195–208. doi: 10.1016/j.actbio.2019.04.053 【25】 Yueyang Qu,Biomaterial,2018,155,41-53 【26】 Yuanjin Zhao et al, Research, 2019, 6906275, DOI: 10.34133/2019/6906275 【27】 Yangyang et al, Biosensors and Bioelectronics, 2019,141(15):111419. 【28】 林炳承,罗勇,刘婷姣,陆瑶著,“器官芯片”, 科 学出版社,352 页,2019 【29】 Zhao Chen et al, 13 March, 2019https://doi.org/10.1002/advs.201801361,Advanced Science 【30】 Kim H J, et al, Lab on Chip, 2012,12(12):2165 【31】 Yahui Ji et al, PNAS, 2019, 116 (13) 5979-5984 【32】 S E Park, et al, Science, Vol 364, Issue 6444, 07 June 2019 【33】 关 一 民 , 器 官 芯 片 技 术 和 产 业 研 讨 会 文 摘 , 2020.9.24-25 致谢:李林梅博士在文稿的技术整理中给予了很多帮助, 深表谢意。 文章来源:《化学通讯》 |

