|
|
微流控芯片+数据独立采集质谱法,简化单细胞蛋白质组学研究发表时间:2022-06-16 16:27 近期,为了更好的利用单细胞蛋白质组学技术,揭示生物过程中的细胞表型异质性和细胞特异性功能网络,台湾中央研究院化学研究所及台湾大学化学系的研究人员提出了一种简化的工作流程,即将微流控芯片用于一体化蛋白质组样品制备和数据独立采集(DIA)质谱(MS),并将该手段拓展到单细胞水平,从而为单细胞蛋白质组学的应用奠定基础。相关研究成果以“Streamlined single-cell proteomics by an integrated microfluidic chip and data-independent acquisition mass spectrometry”为题发表在期刊Nature Communications上。 为了给数量有限的样品提供一个简化的微量蛋白质组学流水线,研究人员设计了一个集成蛋白质组学芯片(iProChip)的微流控装置,提供从细胞输入到完成蛋白质组样品处理的一体化功能。iProChip具有两层、上推的几何结构,可通过程序控制的34个阀门进行精确的流体操作,从而为精确系统控制提供自动化方案(图1)。该芯片由9个单元组成,使多路蛋白质组实验能够同时运行。每个单元包含一个细胞捕获、成像和裂解室,一个蛋白质还原、烷基化和水解容器,以及一个多肽脱盐柱(图1c)。所有装置共用9个进水口和2个出水口,可以同时输送试剂和处理样品,以增加分析通量。细胞捕获器由10、50和100根楔形双柱阵列组成,间隔5μm,分别在5、8.5和11个nL室中快速捕获细胞(图1e)。此外,研究人员制造了一个半径为1mm,高度为100μm(312nL)的圆形腔室,以适应整个蛋白质组工作流程,包括细胞裂解、蛋白质还原、烷基化和水解(图1f)。对于多肽脱盐,研究人员通过将反相C18微珠装入带有5 μm滤片的微通道中来制作了一根横截面为200μm × 25μm且长度为2.5cm的柱子,从而实现了在芯片上的多肽脱盐。为了增加蛋白质组的覆盖率,研究人员采取了一种分析策略,该策略使用Orbitrap质谱仪集成了direct DIA和基于数据库的DIA分析方法。研究人员还利用由不同蛋白质组组成的癌细胞系或免疫细胞,开发了由混合DDA-DIA数据集互补建立的谱图库资源,该资源可以作为数字图谱,从理论上重现DIA数据的m/z和保留时间范围内的所有肽(图1g)。 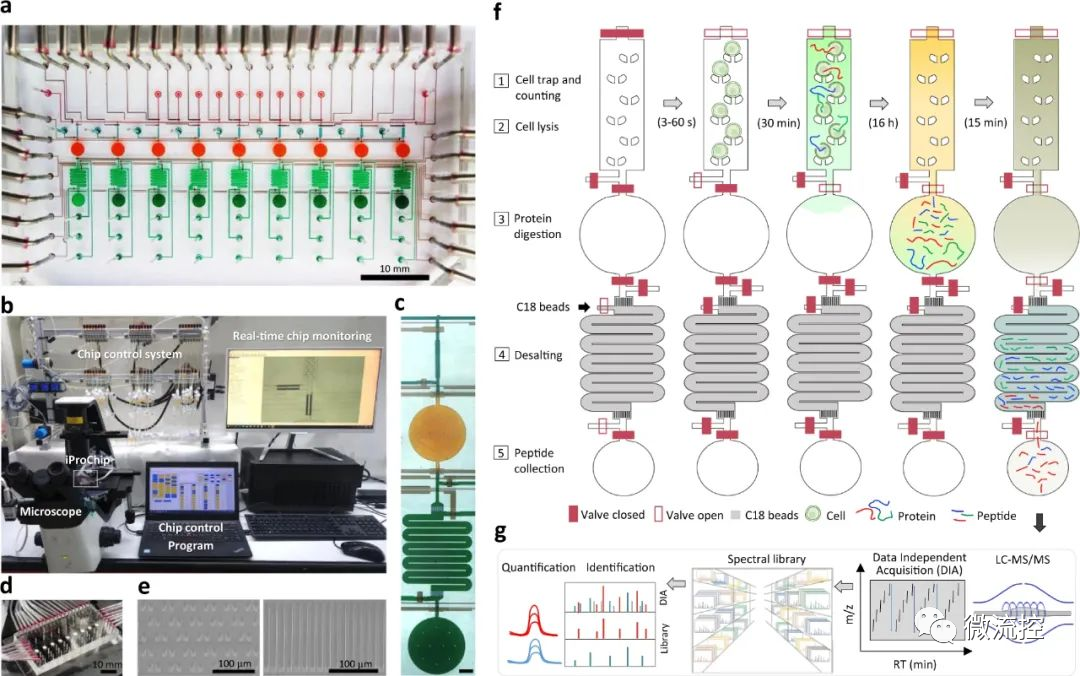 图1 集成蛋白质组学芯片示意图和纳米蛋白质组学的简化工作流程 a)集成蛋白质组学芯片(iProChip)的亮场图像,图中显示了细胞捕获室(青色)、反应容器(橙色)、SPE柱(绿色)、样品采集端口(深绿色)和控制层(棕色);b)iProChip操作的整个系统设置;c)单个操作单元的特写视图(比例尺:300μm);d)安装在显微镜上的即用型iProChip;e)细胞捕获柱(左)和SPE柱中的C18过滤器(右)的SEM图像,这些图像代表了使用扫描电镜观察到的两个芯片;f)iProChip样品制备的操作程序,包括(1)细胞捕获、成像和计数,(2)细胞裂解,(3)蛋白质水解,(4)脱盐和(5)多肽收集;g)蛋白质组学分析示意图,使用基于数据非依赖性采集的液相色谱-串联质谱(LC-MS/MS)和谱图库搜索。 在简化工作流程的第一步,细胞捕获效率是使用非小细胞肺癌(NSCLC)PC-9细胞来测定的。使用最佳细胞密度(500个/μL),每个单元所需的细胞数量(1-100)可以在10-60s内被捕获。单细胞捕集器的平均捕获率分别为100、92±3和89±8%。在对包含1(~90%)和2或3个细胞(~10%)的凹槽进行计数后,研究人员发现所有单元的目标捕获效率达到了100%,该研究将其视为一个可绝对量化的模块,以执行简单和快速的细胞分离(图2a、b)。与独立的细胞分选器相比,这种内置模块提供了简单、快速和高效的细胞隔离。研究人员还评估了iProChip的细胞捕获能力,以表征细胞使用效率(定义为被捕获细胞的数量/总输入细胞的数量)和iProChip操作所需的最小细胞数量,结果表明,捕获1-100个细胞的细胞使用效率范围为4%~44%。接下来,研究人员试图测试在细胞裂解和蛋白质水解过程中试剂是否可以在封闭容器中有效混合。研究测试了三种混合方法,包括涡旋、振荡(板式振荡器)和被动扩散。利用成像分析,研究人员计算相对混合指数(RMI)来评估混合性能。结果表明,涡旋、振荡和扩散混合需要11、16和30分钟才能达到75%RMI,这表明所有三种混合策略都足以在反应动力学的几分钟到几小时内适应反应,这符合进行蛋白质组学工作流程的时间(图2c、d)。虽然发现涡流混合的速度更快,但由于其处理灵活性和足够的反应时间尺度,研究人员在后续实验中采用了这种振荡混合方式。 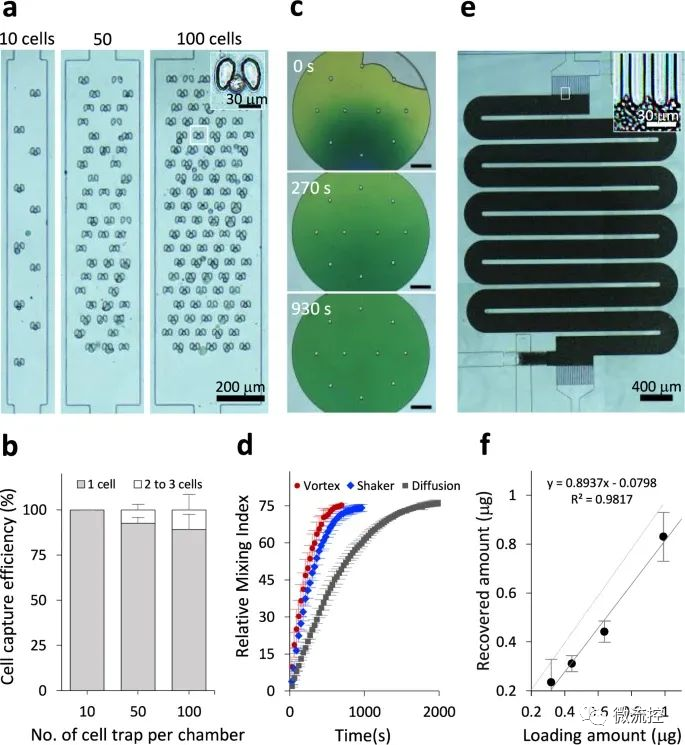 图2 iProChip的性能表征 a)在10、50和100个细胞区室中捕获的非小肺癌PC-9细胞的亮场图像,右上角:被捕获细胞的放大图像;b)表征独立捕获区室的细胞捕获效率,数据用平均值±SD表示(n=3);c)在振荡混合表征过程中装满绿色染料的反应容器的典型时间推移图像(比例尺:300μm);d)反应容器中混合效率的比较,数据用平均值±SD表示(n=3);e)填充有C18微珠的SPE柱的亮场图像,右上角:C18过滤器附近的特写视图;f)SPE柱的脱盐回收率,数据用平均值±SD表示(n=3)。 小型化设备的另一个集成是芯片上的多肽脱盐模块(图2e)。研究人员通过处理约10个细胞来评估脱盐的有效性,其中脱盐样品的谱图显示出可重复的多肽离子谱图轮廓,而未脱盐的样品则显示出洗涤剂的色谱峰。脱盐模块的负载能力和多肽回收率(%)显示出从0.125~1μg的线性相关性,回收率约为89%(图2f)。假设一个典型的哺乳动物细胞含有200pg蛋白质,预计脱盐柱的容量可以从大约4000个细胞中捕获多肽。此外,研究人员通过使有色染料流过C18微珠填充柱来评估由于优先流而导致的损害样品回收。结果表明,9psi是克服优先流的最小流量压力。 此外,研究人员系统地评估了iProChip-DIA在少量细胞蛋白质组学分析的灵敏度、重现性和定量方面的性能(图3)。研究结果表明,iProChip-DIA能够实现高度的稳定性、良好的重现性和低至单细胞水平的蛋白质组学定量能力。这些蛋白质的鉴定使研究人员能够根据KEGG数据库中绘制出肺癌相关的信号通路。本研究总共富集了329条通路,例如NSCLC通路、代谢通路、癌症中的通路、剪接体、病毒致癌、癌症中的蛋白聚糖、MAPK信号传导和细胞凋亡。肺癌的主要通路,NSCLC通路,在不同数量的细胞中覆盖了总共29种蛋白质(图3f)。即使在少量细胞(14±1个细胞)下,研究人员也鉴定出了13种蛋白质,包括药物靶向EGFR、MAP2K1、MAP2K2、MAPK1、MAPK3和KIF5B、肿瘤抑制因子TP53和其他关键信号成分(KRAS、CDK4、CDKN2A、EML4、KIF5B、NRAS、BAX和RB1)。就灵敏度而言,EGFR、MAPK1、MAP2K1、MAP2K2、CDKN2A、TP53、KIF5B和GRB2蛋白仅在5个细胞中被检测到,而MAP2K1、KRAS和TP53甚至可以在单细胞水平上检测到。基于肺癌模型研究,这些结果揭示了所开发的方法具有蛋白质覆盖的能力,并能在有限的细胞数量下研究癌症蛋白质组和广泛的细胞途径。 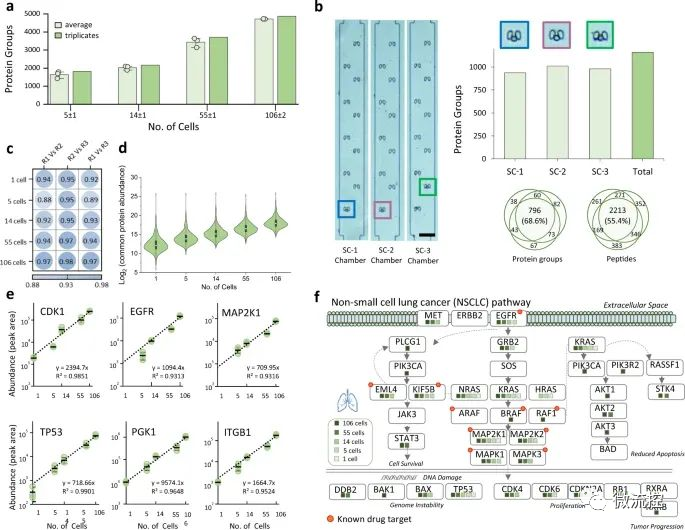 图3 iProChip-DIA在少量细胞蛋白质组学分析的灵敏度、重现性和定量方面的性能 a)通过iProChip-DIA对不同PC-9细胞数目的蛋白质组进行鉴定,数据用平均值±SD表示(n=3个独立细胞样本);b)使用10个细胞捕获室和相应的细胞图像进行单个PC-9细胞捕获,并对已鉴定蛋白质和覆盖范围重复进行三次分析(SC:单细胞,比例尺:100μm);c)在不同细胞数和重复分析(R1-R3)中获得的蛋白质丰度重复性的热图;d)不同细胞数常见蛋白质中总蛋白质丰度的分布;e)肺癌相关蛋白质的代表性例子,图中显示了根据峰面积计算的蛋白质丰度;f)使用京都基因和基因组百科全书(KEGG)数据库鉴定不同细胞数下NSCLC通路内蛋白质的覆盖率。 接下来,研究人员在人B-CLL细胞株MEC-1上验证了iProChip-DIA平台的普遍适用性。当在芯片上处理MEC-1细胞时,iProChip的细胞捕获功能显示MEC-1细胞明显小于PC-9细胞。研究人员使用MEC-1谱图数据库结合dirDIA和libDIA,通过iProChip-DIA对MEC-1细胞进行三次重复分析,在FDR为1%的情况下从117±1、14±1以及单个细胞平均得到3811±362、931±72和455±98个蛋白质(图4a)。研究人员发现蛋白质丰度跨越约5个数量级,并从单个细胞中检测出重要的B细胞表面标志物CD20和HLA分子(图4b),而从14和117个细胞中鉴定出其他关键蛋白质,包括CD19、CD22、CD47和CD74。UniProt的功能注释表明,研究人员从单个MEC-1细胞数据集中鉴定出许多与适应性免疫、先天免疫、激酶、磷酸酶和Ig结构域相关的蛋白质,其中蛋白质覆盖的深度与细胞数量呈正相关(图4c)。通过绘制保存在KinMap中的518种人类激酶,研究人员在激酶系统发育树的所有分支中鉴定出114种蛋白激酶,例如酪氨酸激酶(TK)、TK样激酶、丝氨酸/苏氨酸蛋白激酶、酪蛋白激酶1(CDK1)、和Ca²⁺/钙调蛋白依赖性蛋白激酶(图4d)。虽然MEC-1细胞比PC-9细胞小,但研究人员通过使用iProChip-DIA方法实现了良好的蛋白质鉴定覆盖率和重叠程度(61-81%),表明研究人员的平台对不同细胞类型的通用性和稳定性。 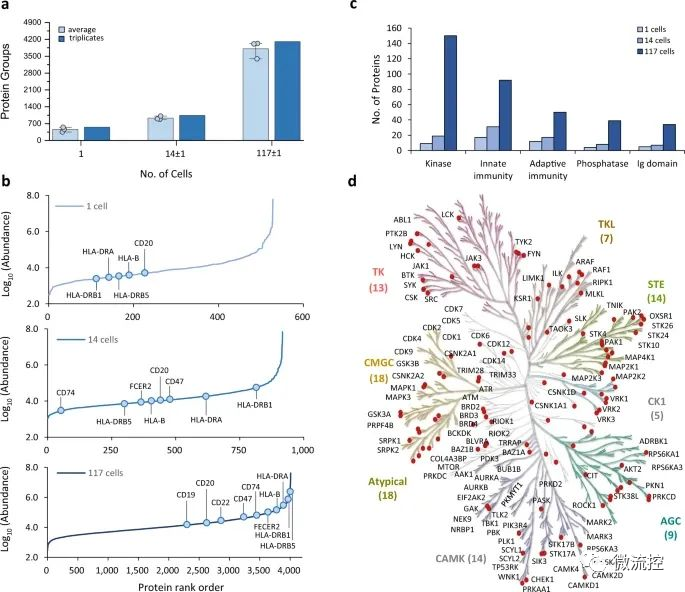 图4 iProChip-DIA在MEC-1细胞蛋白质组学分析中的应用 a)通过DIA-MS偶联iProChip对不同MEC-1细胞数量的蛋白质组进行鉴定,数据用平均值±SD表示(n=3个独立细胞样本);b)基于选择的与免疫癌症标志物相关的蛋白质丰度排序和注释的动态范围评估;c)在UniProtKB数据库中富集免疫相关的和其他功能类别;d)从细胞中绘制114种激酶的激酶树:包括TK(酪氨酸激酶)、TKL(酪氨酸激酶类)、CK1(酪蛋白激酶1)、CAMK(钙/钙调蛋白依赖蛋白激酶)、AGC(包含PKA、PKG、PKC家族)、CMGC(包含CDKs、MAPK、GSK、CLK家族)和STE(许多参与MAPK激酶级联的丝氨酸、苏氨酸激酶)。 总体而言,研究人员基于微流控技术开发了一种蛋白质组学芯片,可减少多步样品转移过程中的样品损失,最大限度地减少了传统工作流程中的表面吸收,从而提高了蛋白质组学的灵敏度,并具有良好的重复性,有望应用在各个领域,其中包括稀少珍贵样本的分析,例如来自临床标本的稀有细胞群。 论文链接: https://doi.org/10.1038/s41467-021-27778-4 文章来源:麦姆斯咨询(“微流控”公众号) |

