|
|
基于微流控的微型肿瘤芯片,用于癌症免疫治疗药效评估发表时间:2022-05-20 16:44 预测个体对肿瘤药物的响应有助于指导治疗决策和提高肿瘤患者生存率。目前,虽然肿瘤病理学、组织学和分子图谱正被整合到个性化医疗中,以指导治疗决策。然而,在个性化医疗中评估肿瘤对免疫治疗的反应仍然是一个巨大的挑战。 据麦姆斯咨询报道,近日,美国印第安纳大学布鲁明顿分校(Indiana University Bloomington)郭峰课题组开发了一种基于微流控的微型肿瘤芯片,用于预测和评估癌症免疫治疗的疗效。相关研究成果以“Evaluation of cancer immunotherapy using mini-tumor chips”为题发表在Theranostic上。 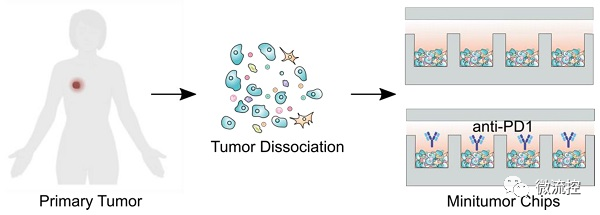 传统肿瘤体外模型,例如原代细胞培养,肿瘤异种动物模型(PDX)和肿瘤类器官只能保留病人肿瘤中的肿瘤细胞成分,而无法复现肿瘤微环境中其他组成成分,特别是免疫细胞的组成、表型以及对免疫检查点抑制剂(ICI)治疗的响应。在此项研究中,研究人员利用微流控芯片技术,将消化的肿瘤组分在微孔中重新形成细胞组分和原肿瘤一致的微型肿瘤。微型肿瘤保留原肿瘤细胞组分的同时,可以实时观察免疫细胞之间以及免疫细胞与肿瘤细胞的相互作用。并且可以平行分析病人原代肿瘤对多种药物,尤其是对ICI的响应。 为了再现体内肿瘤微环境(TME),研究人员设计了具有3个关键特性的微型肿瘤芯片:(1)包含16个通道的大型微孔阵列,每个通道60个孔,以对960个肿瘤细胞成分进行分析;(2)16个平行进样口,允许对每个样品进行16种独立处理研究;(3)半分离反应器,保障有效的细胞灌注和原位细胞间的相互作用,同时局部保留细胞因子梯度(图1)。 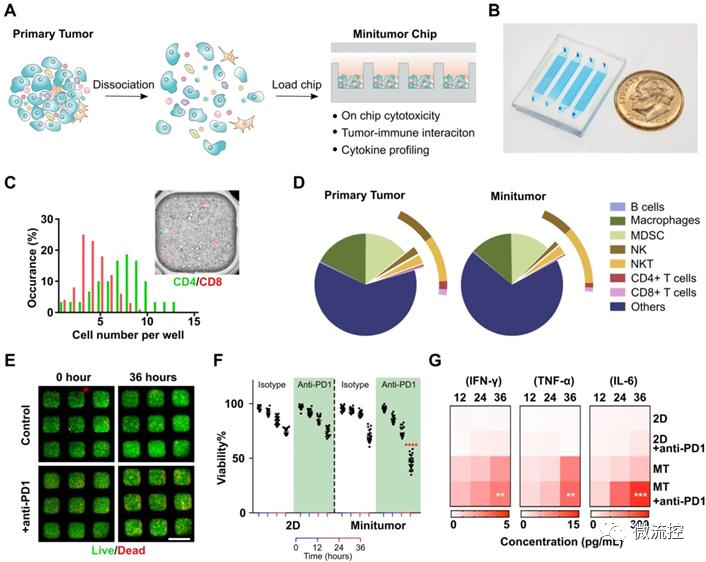 图1 微型肿瘤芯片的工作原理 为了进一步优化和验证微型肿瘤芯片,研究人员首先探索了输注细胞浓度和每个微型肿瘤微孔细胞数之间的关系,研究发现每微孔的细胞数量与输注细胞浓度成比例增加。此外,研究人员通过流式细胞术(flow cytometry)比较了原发性肿瘤和微型肿瘤芯片的细胞成分。数据表明,微型肿瘤芯片上的细胞成分可以代表原发肿瘤的细胞成分。接下来,研究人员检测了抗程序性细胞死亡蛋白-1(programmed death-1,PD-1)抑制剂治疗后的肿瘤细胞活力。结果显示,细胞可以在最初的24h内保持高活力,在36h时活力略有下降。为了测试3D微环境是否可以更好地体现肿瘤的药物反应,对接种到微型肿瘤芯片上的肿瘤细胞与2D培养的96孔板中的肿瘤细胞进行了抗PD1对照实验。结果表明,在微型肿瘤芯片中培养的肿瘤细胞显示出对抗PD1的显著响应。 为进一步验证微型肿瘤芯片并展示其在评估肿瘤对抗PD1治疗响应中的应用,研究人员利用C57BL6小鼠(n=20)建立了原位EO771肿瘤模型,并对荷瘤动物进行一系列抗PD1治疗(图2)。研究发现,大多数小鼠对抗PD1治疗具有抗药性,只有少数小鼠对抗PD1治疗具有良好的响应。接着,研究人员从超级响应者(Responder,RS:其肿瘤体积在第18天消退)以及典型的无响应者(Non-Responder,NS:尽管实施了抗PD1治疗,肿瘤体积仍显示持续增长)中分离出原位肿瘤,并接种到微型肿瘤芯片上。研究发现,微型肿瘤芯片忠实的再现了体内实现结果。在抗PD1处理12h后,可以观察到RS和NR肿瘤细胞活力之间的显著差异,随着培养时间的延长,差异更加显著。此外,研究人员分析了RS和NR肿瘤的成分组成,发现与NR肿瘤相比,RS原发性肿瘤具有显著更高的CD4⁺和CD8⁺ T细胞组成。 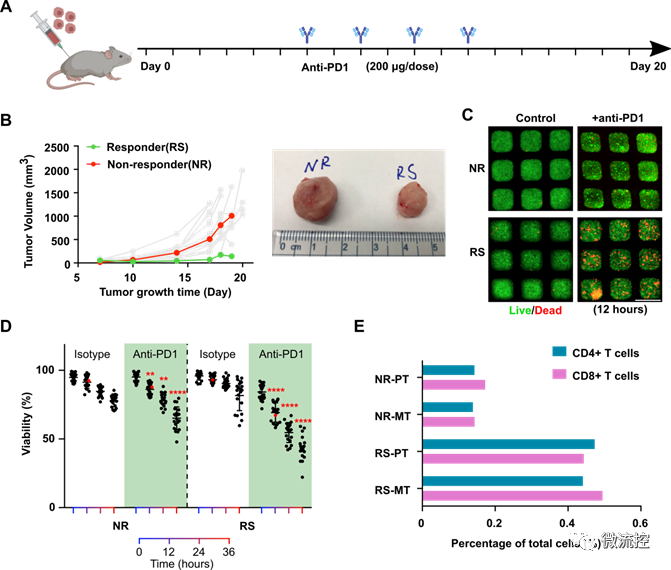 图2 基于微型肿瘤芯片分析原位肿瘤对抗PD1治疗的响应 由于不同的肿瘤成分、T细胞浸润和肿瘤PD-L1表达等,患者对抗PD1治疗的响应差异很大。因此,预测患者对抗PD1治疗的响应对疾病预后以及对患者进行分层具有很大的意义。结果显示,PD-L1基因剔除(PD-L1 knockdown,PD-L1 KD)小鼠对抗PD1治疗的响应最好,这与基于肿瘤芯片的预测一致(图3)。 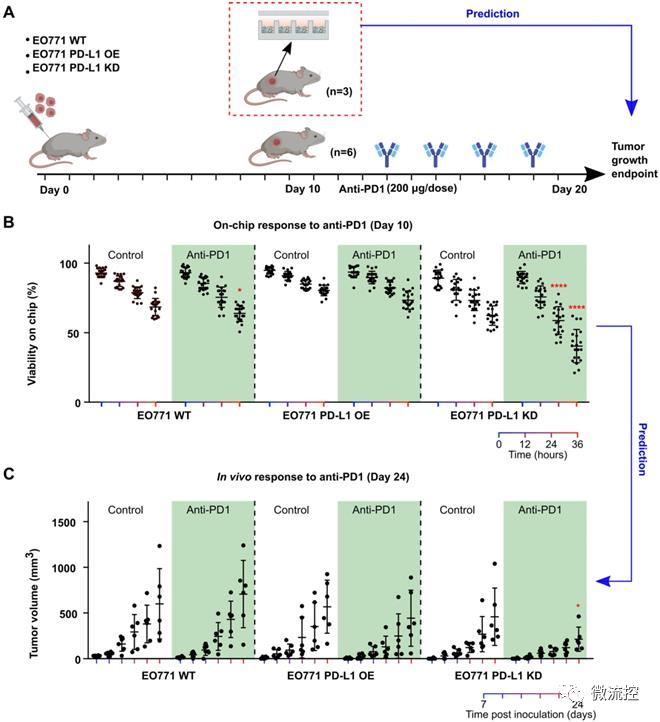 图3 基于微型肿瘤芯片预测原位肿瘤对抗PD1治疗的响应 为了测试微型肿瘤芯片是否可用于ICI药效评估,研究人员从患有雌激素受体和孕激素受体阳性(ER+ PR+)或三阴性乳腺癌(TNBC)患者以及肾细胞癌(RCC)患者身上采集了原发性肿瘤。研究发现来自ER+ PR+、TNBC和RCC患者的原发性肿瘤细胞,可以不同的速率对微型肿瘤芯片上的抗PD1治疗作出响应(图4)。这种响应突出了微型肿瘤芯片在探寻ICI对不同患者疗效的差异性以及未来个性化治疗应用的潜力。 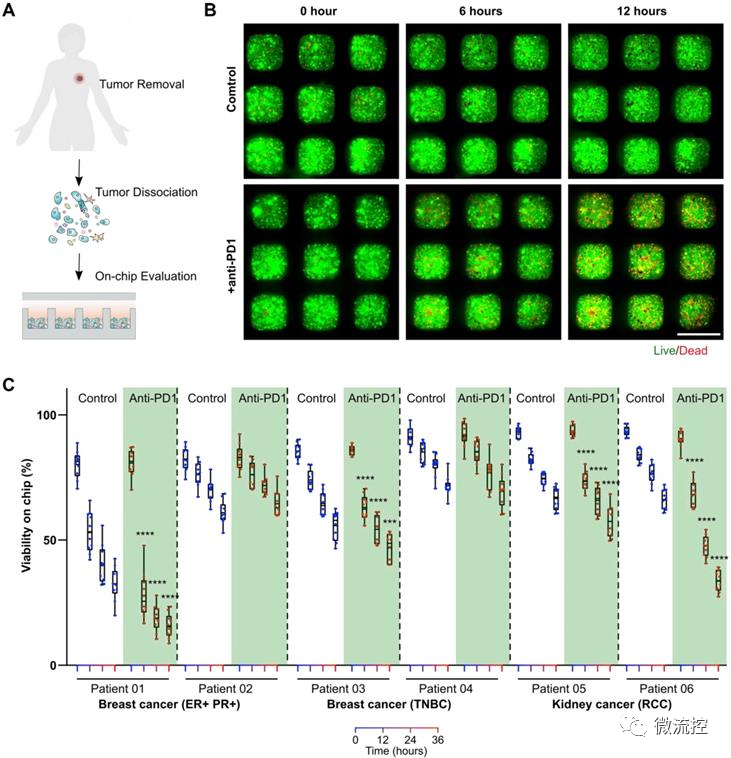 图4 基于微型肿瘤芯片监测癌症患者肿瘤样本对抗PD1治疗的响应 论文链接: https://doi.org/10.7150/thno.71761 文章来源:麦姆斯咨询(“微流控”公众号) |

