|
|
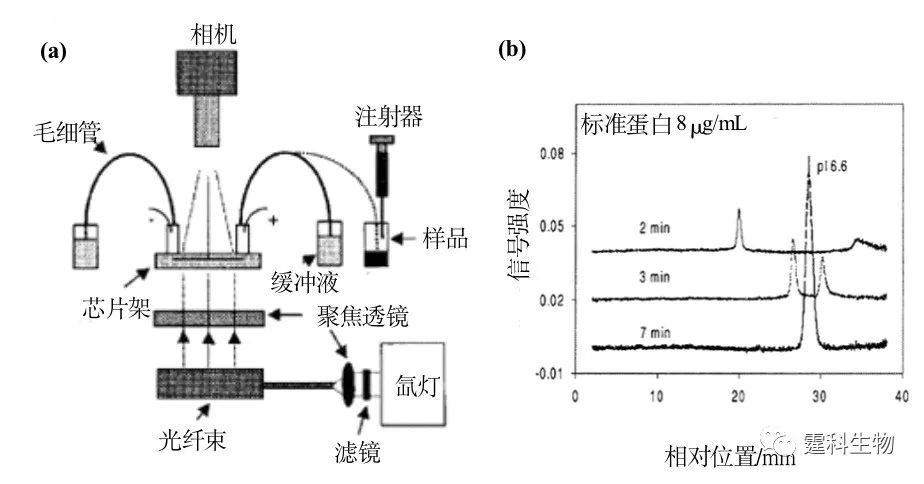
图解微流控|第21期发表时间:2021-11-16 17:14 微分离技术(三) 7.3.1.5 芯片等电聚焦电泳 对于类似蛋白质这样的两性电解质分子而言,其荷电的状况视介质的pH而异。在某一个pH时,蛋白质分子的表观电荷数为零,通常将使某一个蛋白质表观电荷数为0的pH称为这一蛋白质的等电点(pI),不同的蛋白质等电点不同。如果两性电解质分子处于pH与pI一致的介质中而介质又不受电渗的推动,则该组分的定向迁移就会停止。如果介质中的pH是位置的函数,那么有可能使有不同pI的两性电解质分子聚集在不同的位置上,不作迁移而实现分离,这就是所谓的等电聚焦过程。 目前芯片等电聚焦的研究相对较少,主要可能是因为在通道相对较短的芯片上,等电聚焦的分离度难以提高;如果用很长的分离通道,则聚焦时间也相应延长,优势不甚明显;此外聚焦区带的压力推动所需的接口也不容易实现。 在等电聚焦中,电泳的一个很重要的环节是需要一定的推动力(一般采用化学力、静压力和电渗力)将等电聚焦形成的区带推到检测点检测。如果可以对整个芯片通道进行检测,则能省掉区带推动的步骤,实现动态检测聚焦过程。图7-21为在表面涂层的石英芯片上做等电聚焦,CCD做吸收成像检测的成功实例,显示了较好的分辨率,对于实现高通量分离有较大意义[22]。
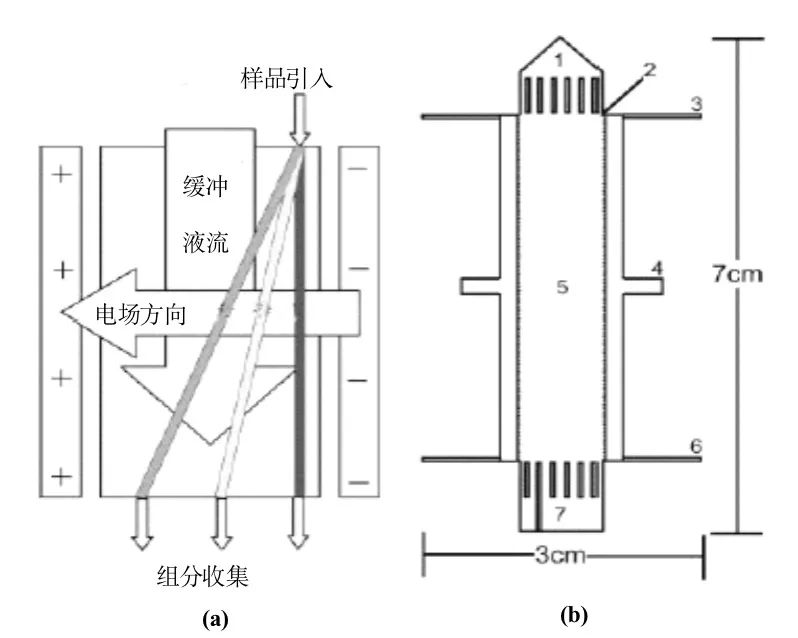
图7-21 石英芯片等电聚焦分离标准蛋白[22] (a) 紫外成相检测mIEF装置示意图;(b) 紫外全柱检测动态mIEF 7.3.1.6 芯片自由流电泳 自由流电泳是指在样品随缓冲液连续流动的正交方向加一直流电场,使被分离物质在流动的同时顺电场方向作电迁移,按电泳倘度大小分离,并在流体末端被接取的一种技术(图7-22)。其分离度取决于流体向下流动的速度和电场的大小。
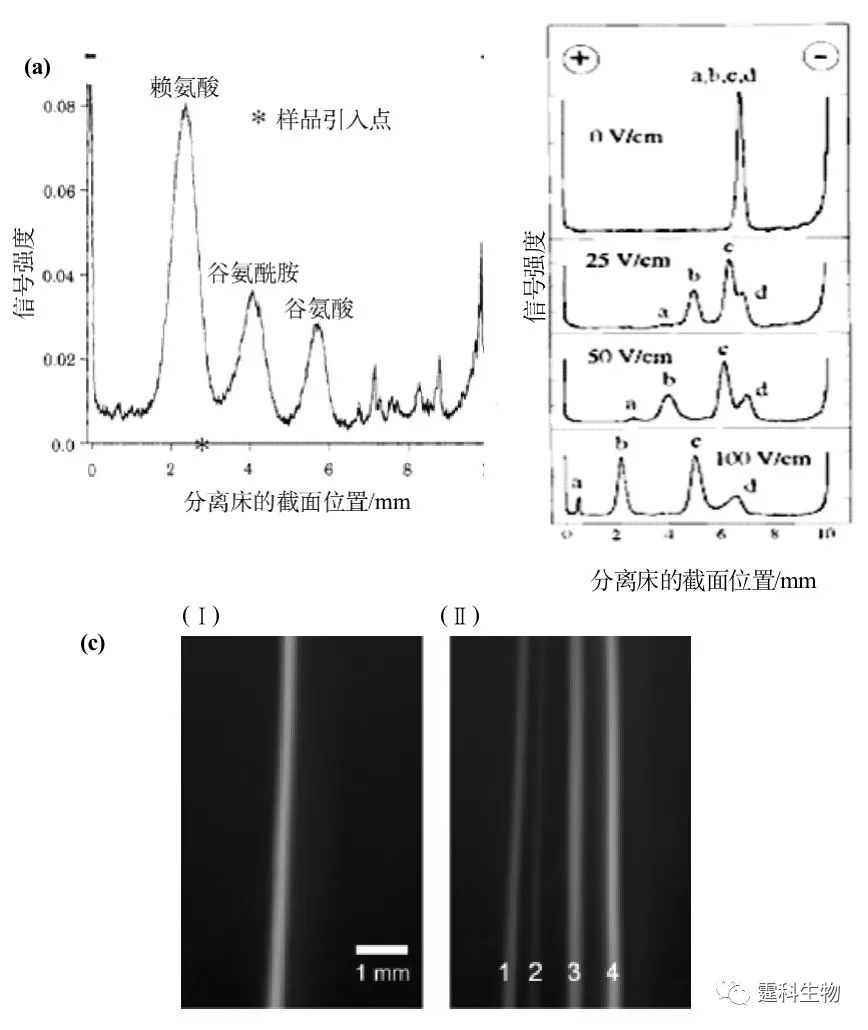
图7-22 自由流电泳示意图 (a)流体运动示意图;(b)分离床的示意图 1. 分离缓冲液入口,2.样品引入口,3. 电极缓冲液入口通道,4.金电极,5.分离通道,6.电极缓冲液出口通道,7. 组分收集出口 它的特点是无需支持介质(如广泛采用的电泳凝胶),且避免了其它材料对分离产物的污染;分离过程连续,产率可以很高。它不仅可用于分析,还可用于制备,发展潜力很大,最常见的是重力自由流电泳。传统的自由流电泳存在很多问题,主要是分离床的体积/表面积之比较大,因此散热较慢,限制了分离电场的使用,影响了分离效率。同时重力作用引起的自然对流会破坏流体的稳定性,稀释分离样品。芯片加工技术的发展有可能给这些问题的解决提供更大的空间。 自由流芯片电泳可以连续加样、持续分离,而且分离条件比较温和,因此非常适合快速分离纯化和微量制备,特别是生物大分子。已有氨基酸[23](图7-23(a))、蛋白质[24](图7-23(b))混合物荧光分子[25](图7-23(c))分离的报道。
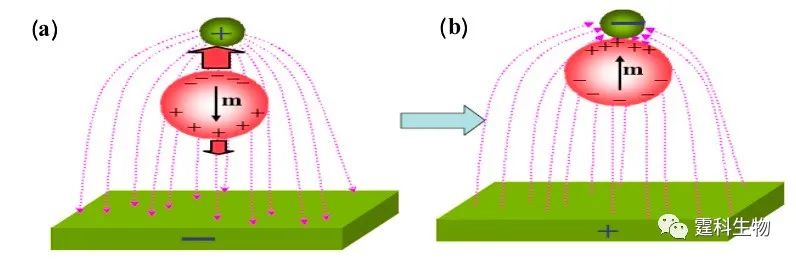
图7-23 芯片自由流电泳分离氨基酸、蛋白质混合物、荧光分子 (a) 自由流电泳分离罗丹明标记的氨基酸[23],分离长度2.4 cm,分离电压50 V,电流7.5 mA,样品0.05 mM溶解在0.04M pH7.0的Na2HPO4/0.03 M KH2PO4缓冲液中,载体缓冲液是pH7.0 0.25 M Na2SO4,流速50 mL/min,到检测点的保留时间是73 s;(b) 在不同的分离场强下自由流电泳分离蛋白质[24]样品,a. 染料小分子,b. 人血清白蛋白,c. 缓激肽;d.核糖核酸酶A;(c) 自由流电泳分离小分子[21, 25]样品,1.荧光素,2.罗丹明110杂质,3.罗丹明110,4.罗丹明123,(Ⅰ) 无电场 ,(Ⅱ) 259 V/cm电场,分离长度2.6 cm 7.3.1.7 介电电泳 电中性颗粒被放置于非均匀电场下时,会产生诱导极化并与电场E 相互作用而产生介电泳动现象。当周围环境的极化率大于颗粒的极化率时,则产生负向介电泳,颗粒向场强最低的区域移动。反之,为正向介电泳,颗粒向场强最高的区域移动。交变电场下正向介电电泳原理示意图见图7-24,大圆球代表电中性颗粒,小圆球和长方体构成非均匀电场。图(a):电场方向竖直向下,电中性颗粒产生诱导极化,颗粒上面偶极矩大于下面,所以粒子向上运动。图(b):电场方向改变后,诱导产生的偶极矩依旧是上面大于下面,粒子仍然是向上运动。
图7-24 正向介电电泳示意图 与电泳中颗粒和分子运动情况不同的是,介电电泳只在颗粒或分子与周边环境存在极化趋势也就是偶极矩存在差异时发生。在芯片上使用的多是相对低频的交变电场(10 kHz 到10 MHz),主要用于100 nm到10 mm的颗粒、微球和细胞的分选、分离[26-33],这时细胞膜或者微粒的表面性质将决定物体的介电性质以及其在电场空间的分布。 作者所在课题组成功构建了基于微流控芯片的介电电泳分析平台(图7-25),设计了一种非均匀排布电极的介电电泳芯片,利用电极表面产生的电热流不同,在自组构建的微流控介电电泳芯片平台上, 实现了两种细胞(K562细胞和红细胞)的空间分离(图7-26)。实验中采用含8.5% 蔗糖, 0.3% 葡萄糖的缓冲液,电导率为560 µs/cm,采用电压10 V,频率800 kHz。
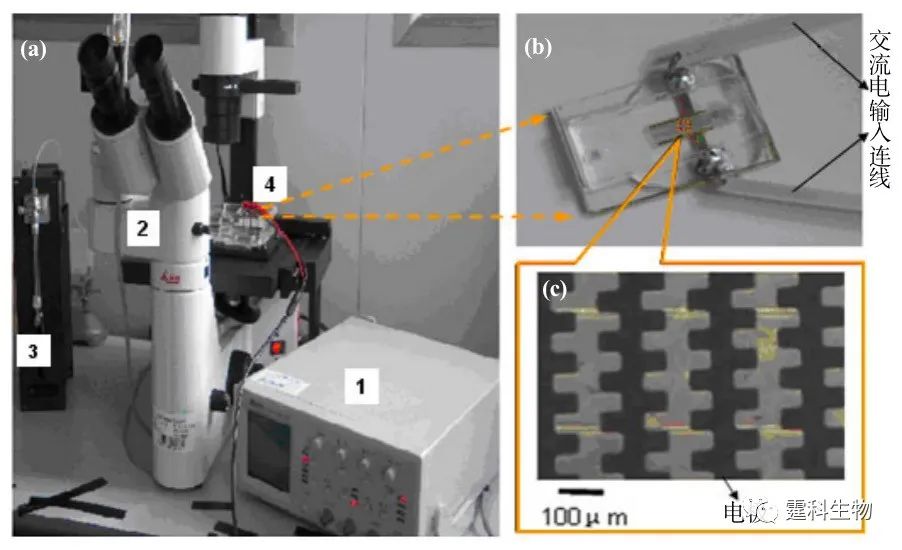
图7-25 微流控芯片的介电电泳分析平台 (a) 介电电泳分析平台,1.函数信号发生器,2.倒置显微镜及CCD,3.微泵,4.介电电泳芯片;(b) 微流控芯片实物图;(c) 城垛型电极图
图7-26 流动状态下利用介电泳力分离 K562细胞和红细胞 (a) 均匀电场下K562细胞受正向介电泳力而被吸附在电极两侧,而红细胞则倾向于吸附在顺流方向一侧电极边缘;(b) 非均匀电场下K562细胞被吸引在逆流方向电极边缘(>90%),红细胞(>90%)则被吸引在顺流方向的电极边缘,实现两种细胞的空间分离 由于不均匀排布电极引起的电热流可能在通道的不同高度形成不同方向的涡流,因此对不同大小的细胞产生了不同的影响,从而实现细胞的分离。 7.3.2 多维芯片电泳 多维分离是指将几种分离原理完全不同的分离方法集成,构建成多维分离系统,并用于对复杂样品分离的一种方法。与一维分离模式相比,多维分离可以极大提高分辨率和峰容量,能够便捷地调整分离选择性,减小峰重叠,提供更多样品信息。其中二维电泳(通常为等电聚焦结合凝胶筛分模式)是目前比较常见的多维分离方法。 以微流控芯片为平台进行的分离操作不仅可以有效地实现两种分离模式之间的零死体积切换,而且能够使分析速度与峰容量的矛盾得到补偿。多维分离系统中不同分离模式之间组合通常采用接口实现,而死体积引入往往引起额外谱带展宽,因此,切换接口设计是构建多维分离系统关键技术。在芯片上集成分离通道可以使通道结构交叉或连接处死体积近乎为零,仅仅通过简单电压切换,即可实现自动化进样、注入、分离等毛细管分离分析基本操作,不但柱效极高,而且分离速度极快[34]。 7.3.2.1 胶束电动色谱-自由溶液区带电泳(MEKC-CZE) 前已提及MEKC的分离机理是基于被分离物在SDS胶束中分配平衡,而CZE则是基于被分离物的荷质比,两种分离模式的偶合有可能增加分离过程的峰容量。 以Ramsey实验室初步的实验为例[35],芯片构造如图7-27所示,芯片的第一维分离通道长度是69 mm,分离时间大约是500 s;第二维分离通道长度10 mm,分离时间大约是6 s。每间隔4 s将第一维的分离的流出物作为样品导入第二维(图7-27),分离缓冲液都是50 mM 三乙胺,25 mM 醋酸,pH10.7,在第一维的缓冲液中加入10 mM的SDS胶束。他们在这样的芯片上成功的分离了多肽混合物(图7-28)。
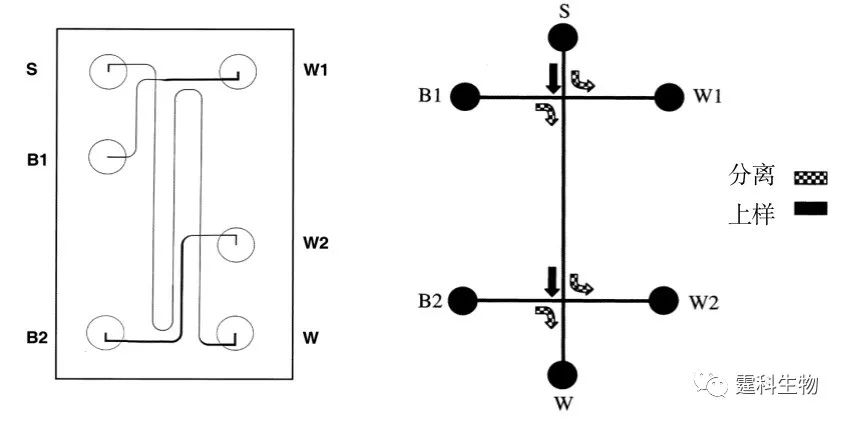
图7-27 MEKC-CZE二维分离芯片图及微流通道中流体流向示意图[35] S.样品池;B1、B2. 缓冲液池;W、W1、W2. 废液池
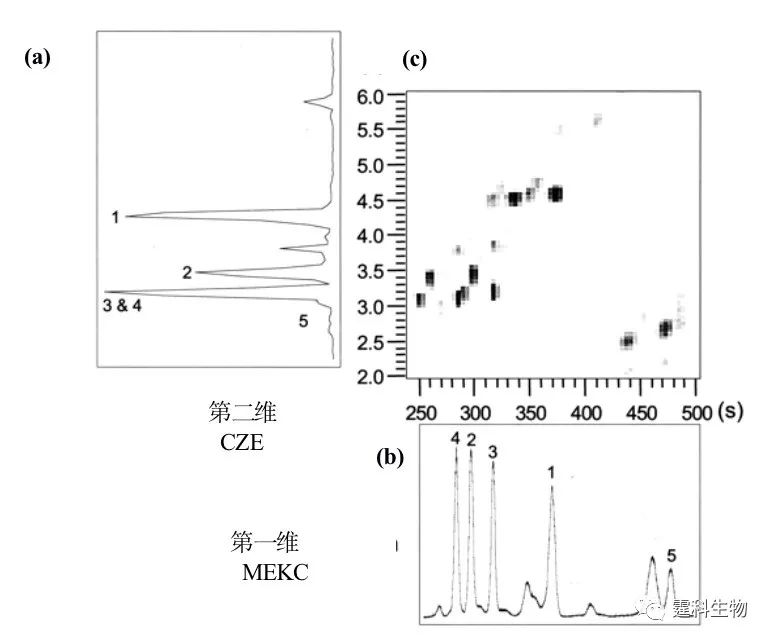
图7-28 MEKC-CZE分离肽混合物电泳图[35] 1.leucine enkephalin,2.angiotensin I,3.angiotensin III,4.neurotensin,5.bradykinin。(a)和(b)的谱图曲线分别表示二维电泳(c)在两个维度的投影 7.3.2.2开管电色谱-自由溶液区带电泳(OCEC-CZE) 开管电色谱可以将混合物按分配系数分离,自由溶液区带电泳可以将组分按荷质比分离,将两种分离模式偶合有可能增加分离过程的峰容量。 以 Ramsey实验室的另一实验[36]为例子简要说明:芯片如图7-29(a)所示(S:样品池;B1、B2:缓冲液池;W:废液池;箭头表示检测点),在25平方厘米的玻璃芯片上,第一维螺旋状的开管电色谱微分离通道长25 cm(即图7-29(a)中V1到V2),第二维的自由溶液区带电泳通道长1.2 cm(即图7-29(a)中V2到检测点),为了减少转角区带扩散,芯片的通道很窄,只有10.8 mm 深,34 mm 宽[36]。第一维的开管电色谱通道中有十八烷基的硅烷化涂层,分离场强220 V/cm,自由溶液区带电泳分离场强1890 V/cm。缓冲液都是10 mM 硼砂和30% ( v/v )乙腈。起始0.5 s OCEC 进样,然后分离;在 OCEC 分离过程同时0.2 s CZE 进样,3 s CZE 分离。一个循环周期3.2 s 。在该芯片上对 b-casein 的胰蛋白酶水解混合物分离效果很好。
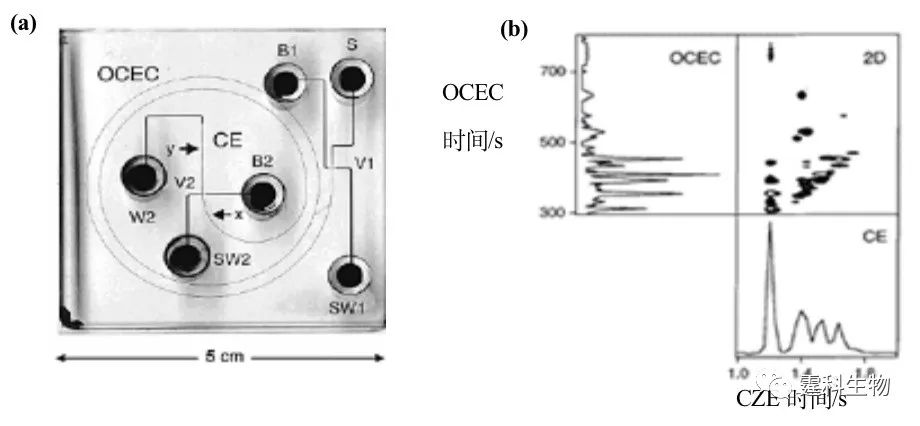
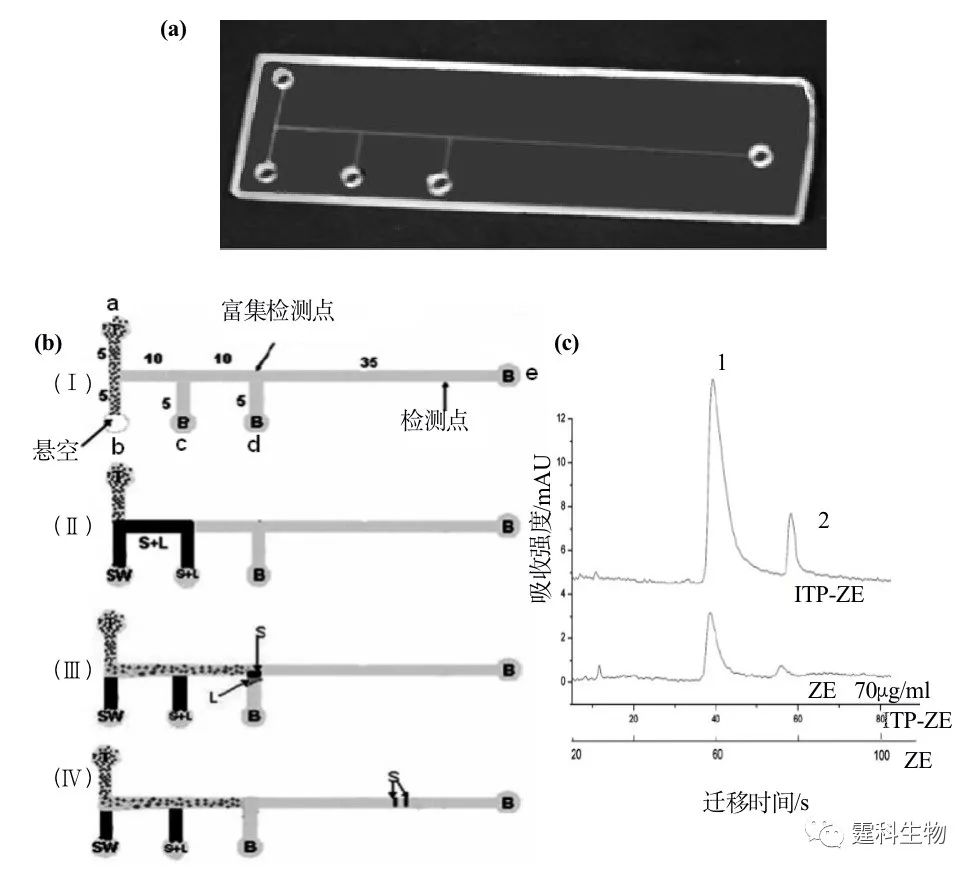
图7-29 OCEC-CZE 二维电泳分离[36] (a) 芯片外观图;(b) OCEC-CZE 二维分离 b-casein 水解混合物电泳图 7.3.2.3 等速电泳(ITP)-自由溶液区带电泳(CZE ) 作者课题组利用自制的带有紫外检测的微流控工作平台,在石英芯片上进行等速电泳-自由溶液区带电泳二维分离了两种类黄酮(图7-30),同单独的区带电泳分离相比,检测限降低了32倍[37]。
图7-30 ITP-ZE 二维电泳分离[37] (a) 用于 ITP-ZE 分离的石英芯片实物图;(b) 芯片上 ITP-ZE 分离操作步骤,S.样品,SW.样品废液池,B.背景电解液,L.前导电解液,T.尾随电解液,Ⅰ.B、T上样,Ⅱ.S 、L进样,c接地,b接高压,Ⅲ.富集过程,a接地,d接高压,Ⅳ.分离过程,d接地,e接高压; (c) ITP-ZE与ZE分离模式的比较,1.栎精,2.异鼠李素 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |