|
|
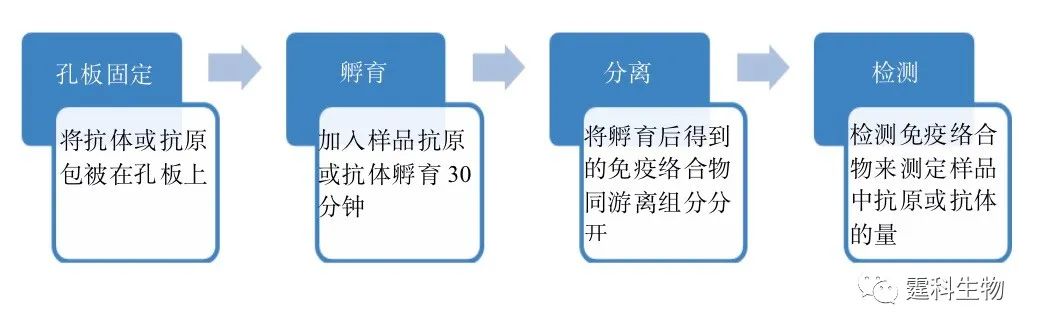
图解微流控|第18期发表时间:2021-11-02 16:10 微混合和微反应技术(四) 6.10 免疫反应 由抗原、抗体或半抗原参加的反应称为免疫反应。 现阶段最常用的免疫反应检测方法是96孔板法。96孔板免疫检测的基本过程如图6-55所示。
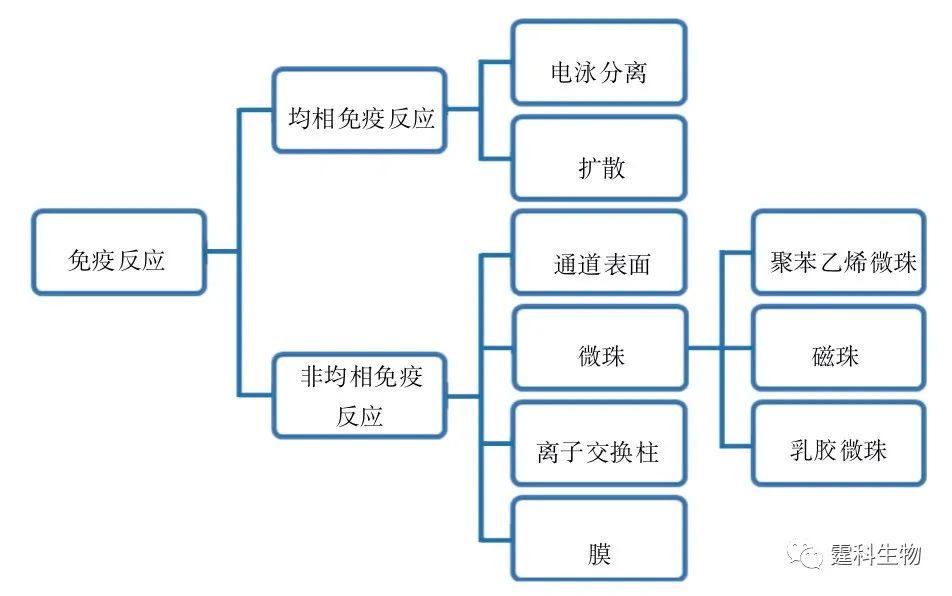
图6-55 96孔板免疫检测的基本过程示意图 在微流控芯片上开展免疫反应具有如下的优势: (1) 反应体积可达到纳升至皮升级,适用于血液、尿液及其他复杂样品中痕量物质的分析; (2) 反应动力学过程快,反应时间短; (3) 实验设计更加灵活,检测手段更为丰富; (4) 可以集成多种不同单元,操作简单,易于实现高通量,便于自动化、微型化。 6.10.1 免疫反应的分类 微流控芯片上常见的免疫反应按作用介质的均一与否,分类如图6-56所示。
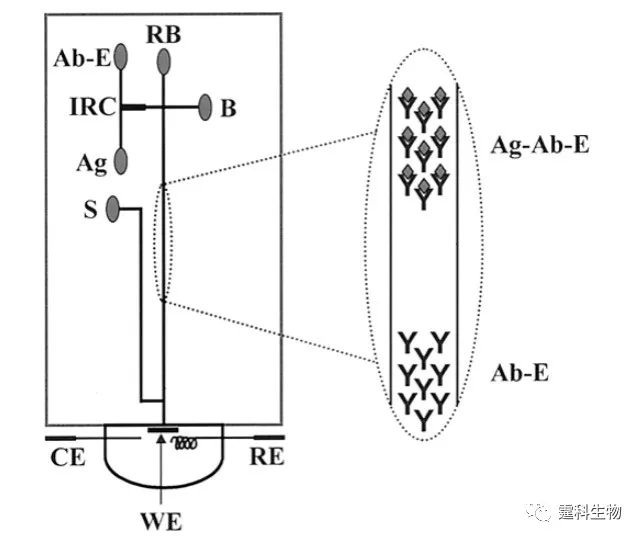
图6-56 微流控芯片常见免疫反应分类 6.10.2 均相免疫反应 在同一介质中进行的免疫反应称为均相免疫反应。 6.10.2.1 电泳分离模型免疫反应 电泳分离型免疫反应是利用毛细管通道将混合、反应、进样和分离等各个单元联系起来,依靠电渗作为驱动力,完成整个免疫反应过程。 (1)基于毛细管电泳的单样品均相免疫反应 以酶或其相关分子(如辅酶、酶抑制剂和底物等)作为标记物标记抗原或抗体,利用酶对底物的催化作用来检测抗体或抗原含量的免疫反应被称为酶免疫反应。以图6-57和图6-58所示的酶免疫反应为例说明基于毛细管电泳的单样品均相免疫反应过程。
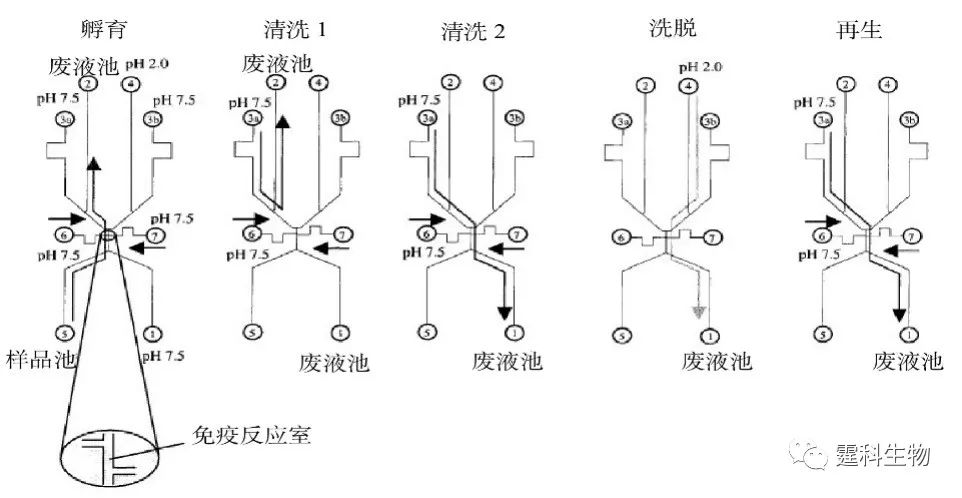
图6-57 基于毛细管电泳的均相酶免疫反应芯片设计图[87] Ag.鼠免疫球蛋白样品池;Ab-E.碱性磷脂酶标记抗鼠免疫球蛋白抗体试剂池;IRC.免疫反应室;RB运行缓冲液池;S.底物池;CE.对电极;WE.工作电极;RE.参比电极.B.池在该研究中没有使用
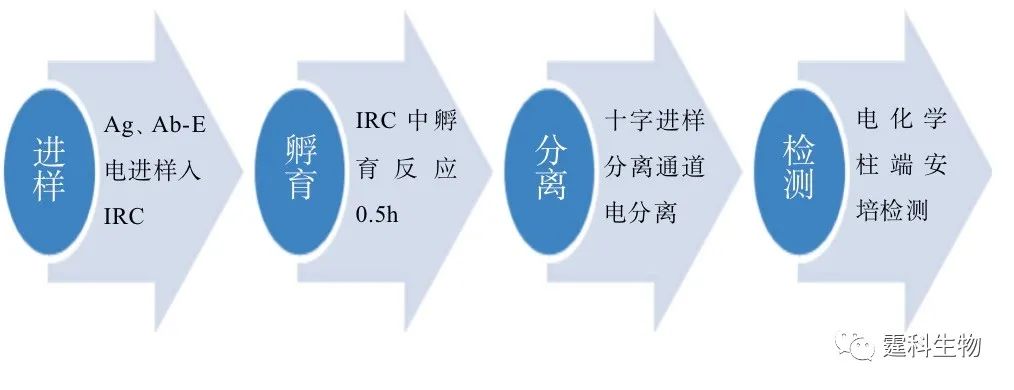
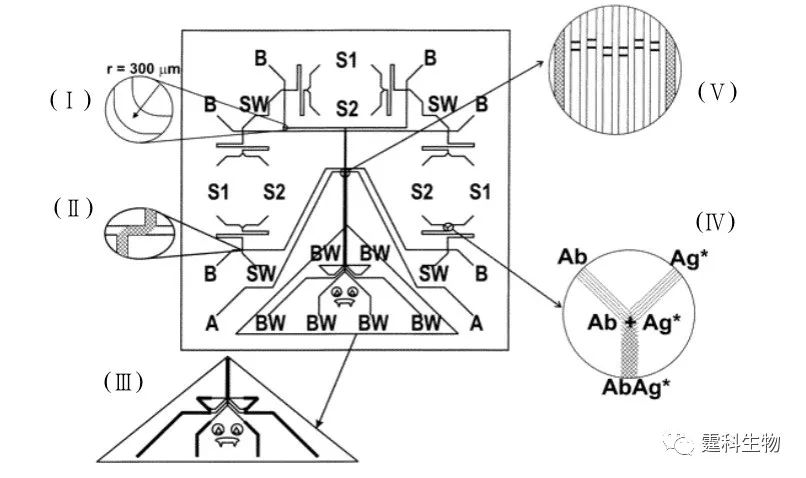
图6-58 基于毛细管电泳的均相酶免疫反应过程示意 在图6-57所示的芯片上,可利用酶免疫反应检测鼠免疫球蛋白G。利用该种芯片对鼠抗IgG进行检测,检测限可达到2.5×10-16 g/mL[87]。其基本的反应过程如图6-58所示。 (2)基于毛细管电泳的多样品均相免疫反应 图6-59 是阵列毛细管电泳免疫反应芯片—“SPIDY”芯片的示意图。
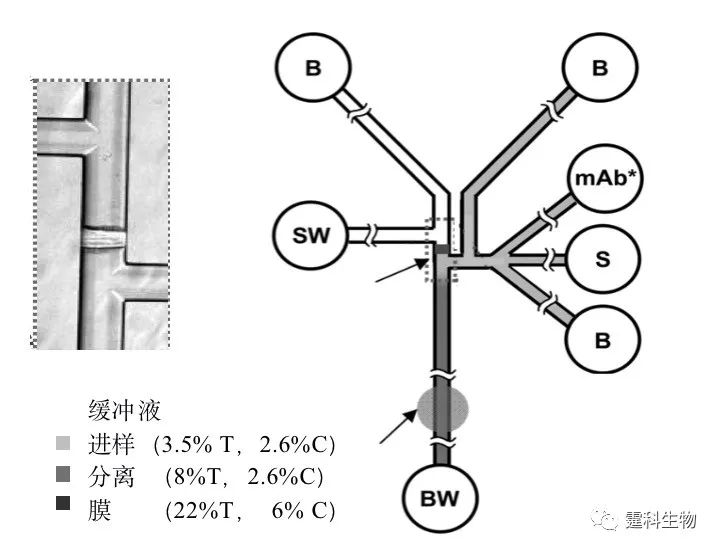
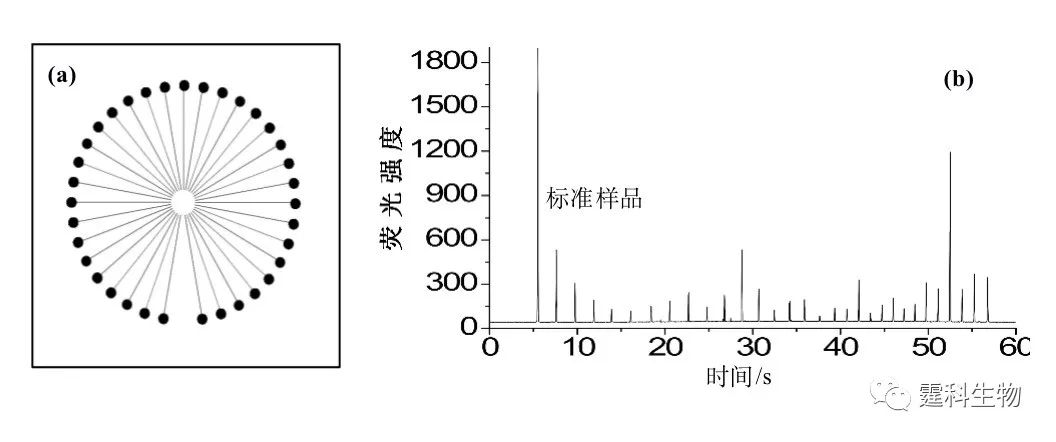
图6-59 “SPIDY”芯片[88] S1.样品池;S2.抗体池;SW.样品废液池;B.运行缓冲液池;BW缓冲液废液池。(Ⅰ)为分离通道的入口处半径为300 µm圆形拐角的放大图;(Ⅱ)为双T构型进样口的放大图;(Ⅲ)为缓冲液废液池处通道构型放大图;(Ⅳ) 为抗原、抗体在反应器中混合、反应的放大图;(Ⅴ)为检测区放大图 该芯片在16 mm × 16 mm的芯片上集成六个平行的反应单元,每个独立单元包括混合、反应、进样、分离等操作功能。利用此芯片,采用均相直接免疫反应(不加入竞争性抗原或抗体)检测了卵清蛋白和抗雌二醇,在60 s内完成混合、反应、分离、检测等整个过程,大大缩短了反应时间,测定抗雌二醇的检测限达4.3 nmol/L[88]。 (3)基于聚丙烯酰胺凝胶电泳分离的免疫反应 图6-60 为基于聚丙烯酰胺凝胶电泳分离的均相免疫反应芯片示意图。芯片通道中被灌入不同浓度的聚丙烯酰胺凝胶,采用电泳分离的模式对唾液中胶原蛋白裂解酶基质金属蛋白酶-8(MMP-8)直接分离检测,无需对样品进行前处理[89]。
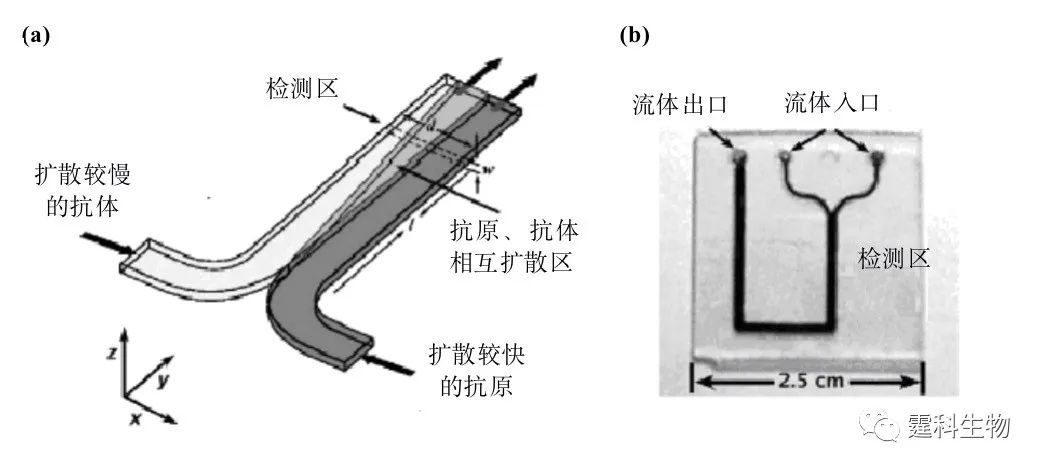
图6-60 基于聚丙烯酰胺凝胶电泳分离的均相免疫反应芯片示意图[89] S.样品池;B.缓冲液池;SW.样品废液池;BW.缓冲液废液池; mAb*.荧光标记的MMP-8抗体;%T为丙烯酰胺含量;%C为胶联剂含量; 体积排阻膜用于对实际样品的纯化处理 6.10.2.2 扩散型免疫反应 抗原的分子量一般小于10 kDa,抗体则相对较大,一般大于150 kDa,抗原在溶液中的扩散速度要比抗体快10倍。利用这种特性,建立了抗原与抗体的结合完全依赖溶液扩散力的免疫反应。 图6-61为依赖溶液扩散力的实现免疫反应的芯片示意图[90]。在通道的一端注入抗体,另一端注入荧光标记的抗原和待测抗原混合液,两条通道逐渐汇聚成“T”字型,在此处两种不同的溶液相互接触,形成并行的薄片状的层流,由于抗原比抗体扩散快,在层流的接触面就会被抗体捕获,扩散速度减慢。这样在溶液中就会形成自由抗原和抗原-抗体复合物的浓度梯度,这种浓度梯度是抗原浓度的函数,可被CCD检测到,通过特定的软件,对抗原浓度定量。利用此芯片对血液中苯妥英(一种抗癫痫药)进行检测,反应时间小于1 min,检测限可达0.43 nM。
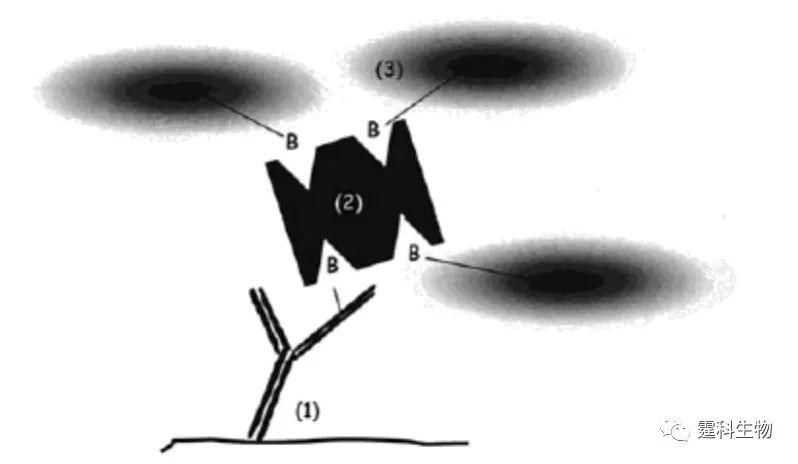
图6-61 扩散免疫反应[90] (a)原理图;(b)芯片实物图 6.10.3 非均相免疫反应 非均相免疫是指将抗原(或抗体)固定在固相载体表面,通过特异性免疫反应,将所需的抗体(或抗原)结合在固相表面形成抗原-抗体复合物的反应。 酶联免疫吸附实验(ELISA)是常见的非均相免疫分析方法。这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,使受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为能被某种特定检测方式检测的产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅进行定性或定量分析。 6.10.3.1 通道表面免疫反应 (1)以三元亲和涂覆法修饰的通道表面为固相载体进行的免疫反应 无论玻璃还是塑料对蛋白质等生物大分子均有很强的吸附能力,以三元亲和涂覆法对通道表面进行处理可以有效的避免非特异性吸附。如图6-62 所示,Linder等利用三元亲和涂覆技术检测人IgG,检测限可达200 µg/mL[91]。
图6-62 三元亲和涂覆法修饰通道表面[91] (1)生物素修饰的IgG;(2)中性亲和素蛋白;(3)生物素修饰的右旋糖苷 通道表面第一层涂布经生物素耦联的IgG,第二层为中性抗生物素蛋白,第三层则是生物素耦联的右旋糖苷,层与层之间靠中性亲和素蛋白与生物素之间的强相互作用连接,经此修饰后的管壁基本消除了对生物大分子的吸附,而且还能维持适中的电渗流 (2)以硅烷化的玻璃通道表面作为固相载体进行的免疫反应 在通道局部引入硅烷化试剂(氯化二甲基烷基硅烷,CDMODS),硅烷化的通道表面易于固定蛋白A,蛋白A可选择性捕捉待测样品中的IgG。图6-63是利用此方法检测兔IgG(rIgG)的示意图,对rIgG的最低检测限为50 nmol/L[92]。
图6-63 通道表面免疫反应过程[92] 通道的双T形交叉部位为免疫反应室,此处经硅烷化后固定蛋白A,将Cy5标记的rIgG引入免疫反应室,孵育,rIgG将被捕捉到免疫反应室的表面进行免疫反应 (3)以具有蛋白吸附功能的PDMS通道表面作为固相载体进行的免疫反应 PDMS是一种表面疏水性的高聚物,对蛋白等非极性物质吸附强烈,利用这一特点,在通道表面直接固定抗原(或抗体),用于检测样品中的抗体(或抗原)。 ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。作者所在实验室研制了多通道PDMS的皮质醇酶联免疫吸附反应(ELISA)检测系统,可以采用化学发光和激光两种检测方法。结果见图6-64[92]。
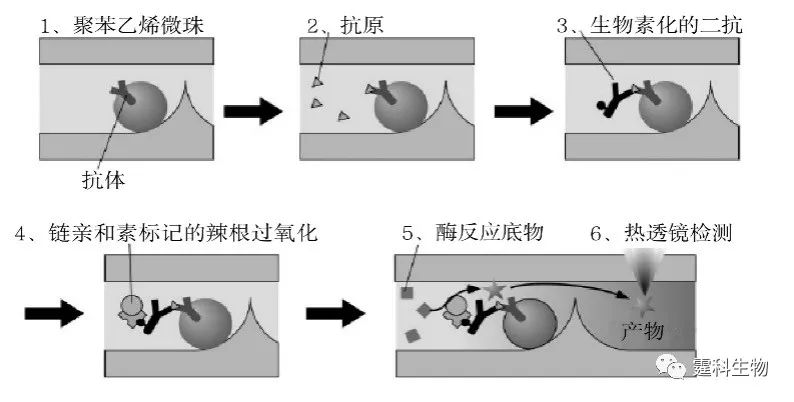
图6-64 以PDMS通道表面作为固相载体进行的免疫反应[93] (a)为ELISA芯片示意图,外周为样品池,中间为公共废液池; (b)为血清皮质醇激光检测结果(注:前六个为皮质醇的标准样品,确定标准曲线,后面为1-25号血清的检测结果) 具体过程如下: (1)外周样品池加入皮质醇抗体; (2)中间废液池抽吸; (3)皮质醇抗体进入通道; (4)室温孵育包被; (5)洗去通道中残留抗体; (6)引入抗原混合物; (7)皮质醇竞争反应; (8)酶标底物催化反应; (9)检测。 6.10.3.2 微珠免疫反应 (1) 聚苯乙烯微珠免疫反应 以聚苯乙烯微珠作为固相载体的免疫反应芯片需加工一物理栅栏(坝),用以拦截微珠。采用酶联免疫吸附法的聚苯乙烯微珠免疫反应过程[94]如图6-65所示:1、表面绑定抗体的聚苯乙烯微珠;2、加入待测样品抗原;3、加入生物素化的二抗;4、加入链亲和素标记的辣根过氧化物酶;5、加入底物进行酶反应;6、热透镜检测。用该方法检测人干扰素-γ,检测限可达到0.1 ng/mL。
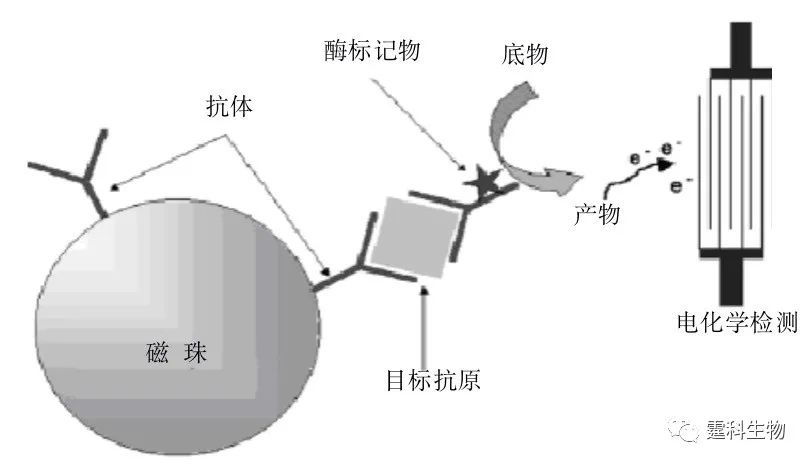
图6-65 以聚苯乙烯微珠进行的ELISA免疫反应过程示意图[94] (2) 磁珠免疫反应 采用磁珠作为固相载体进行非均相免疫反应,可以取消用于拦截微珠的物理栅栏。图6-66显示了以磁珠作为固相载体进行非均相免疫反应免疫反应原理[95]。
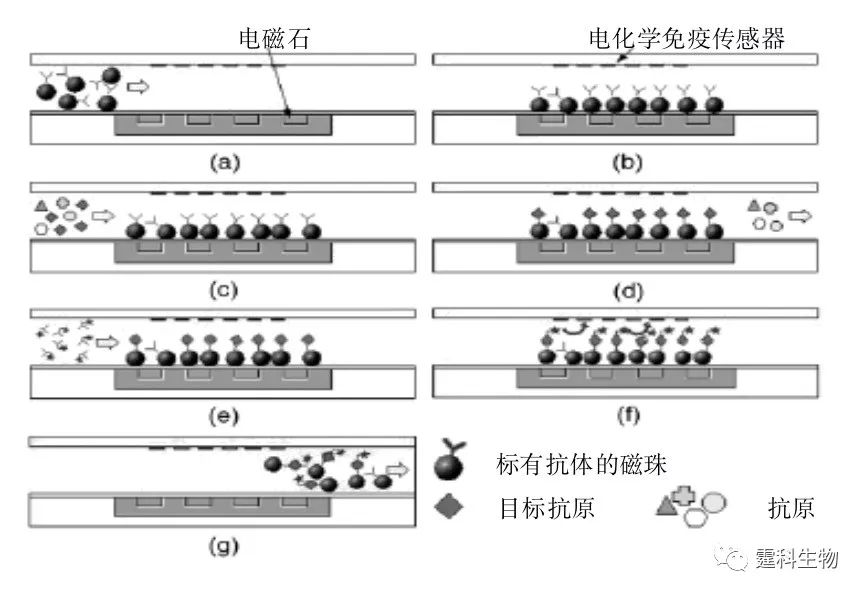
图6-66 磁珠作为固定相的免疫反应原理示意图[95] 微流控芯片主板上固定有电磁石,通电后会产生电磁场,在电磁场力的作用下,很方便地将磁珠引入并附着于通道表面进行免疫反应,反应结束后撤去电磁场,释放磁珠进入检测口检测并排出。反应的具体过程如图6-67所示:
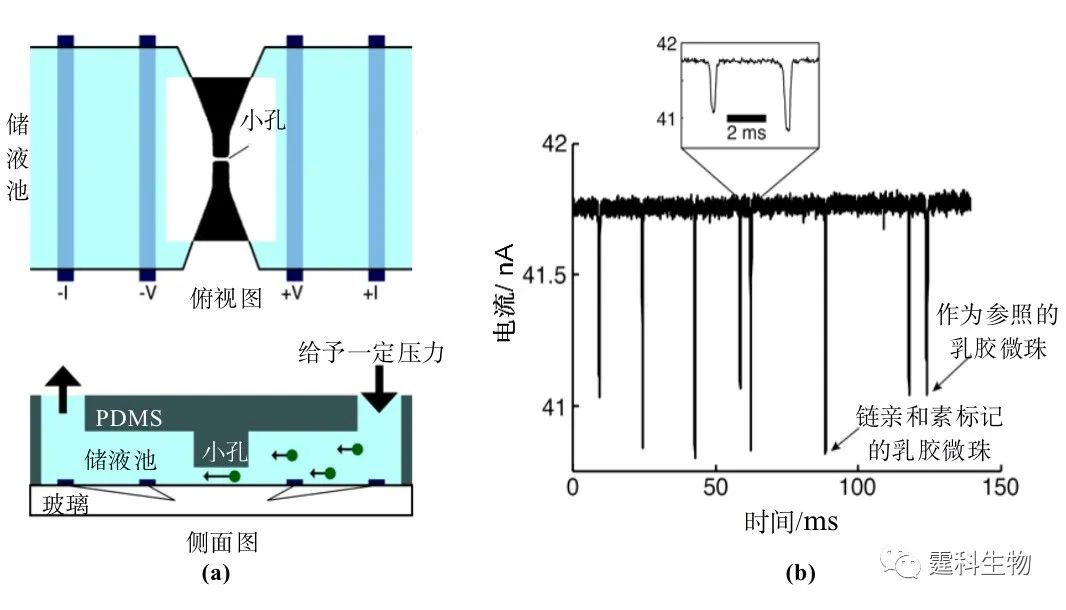
图6-67 以磁珠作为固定相的免疫反应过程示意图[95] (a)引入连有抗体的磁珠; (b)在电场力的作用下磁珠均匀分散并固定; (c)泵入含有目标抗原和其他抗原的样品; (d)通过抗原、抗体相互作用固定目标抗原; (e)引入带有酶标记物的二抗; (f)加入酶反应底物,酶反应后进行电化学检测; (g)撤去电场,洗掉磁珠,可进行下一次反应。 用该方法检测鼠IgG,检测限可达100 ng/mL,样品消耗量小于10 µL。 (3)乳胶微珠免疫反应 在导电溶液中,当电绝缘性的乳胶微珠穿过一个小孔时,会引起小孔暂时性的电流下降,不同直径的微珠引起电流下降的幅度不同,利用这一原理,将不同大小的抗体绑定在相同大小的乳胶微珠上,通过测量电流下降的幅度和频率,可判断抗体的种类及浓度。图6-68为一个基于乳胶微珠孔透过的免疫反应芯片示意图[96]。
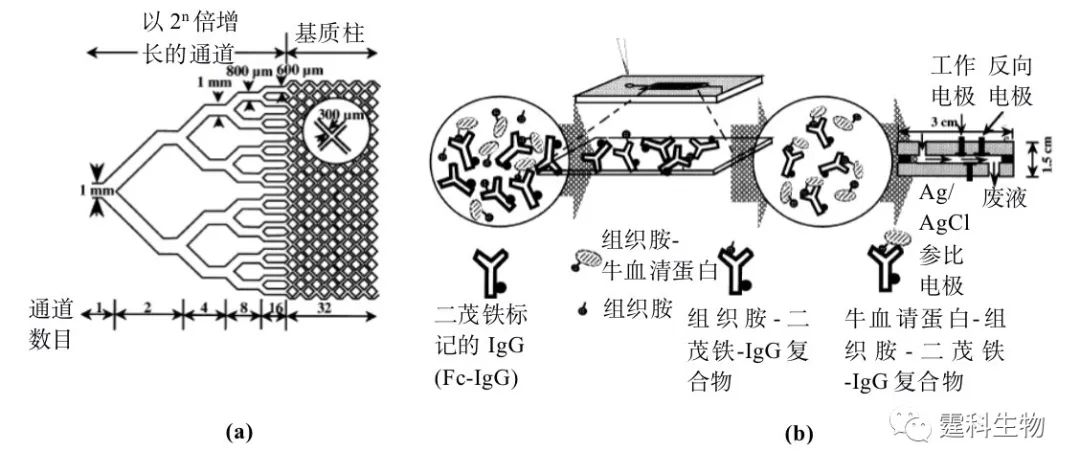
图6-68 以乳胶微珠为固定相的免疫反应[96] (a) 乳胶微珠免疫反应的芯片示意图;(b) 不同大小的乳胶微珠穿过小孔时产生不同幅度电流下降的示意图 6.10.3.3 离子交换柱免疫反应 利用阳离子交换柱作为固相载体进行免疫反应的原理是:在通道表面覆盖一层阳离子交换树脂,利用各种抗原(或抗体)的等电点不同将其分离。 图6-69是采用竞争法测定全血中组织胺的阳离子交换柱免疫反应示意图,以PMMA为基质,以计算机辅助分子建模(CAMM)制成具有2n个通道的柱子,柱子外面覆盖了一层阳离子交换树脂。将二茂铁标记的IgG(Fc-IgG)和组织胺-牛血清蛋白、含有未标记组织胺的全血样品混杂在一起,孵育0.5 h后,反应混合物包括有游离的组织胺、组织胺-牛血清蛋白、Fc-IgG、组织胺-Fc-IgG复合物和组织胺-牛血清蛋白-Fc-IgG复合物。后四种物质的等电点分别为5.6、7.0、7.2、6.0,这就意味着,当柱内充满pH 6.5的丙二酸缓冲液时,Fc-IgG和组织胺-Fc-IgG复合物就会带有正电荷,于是和阳离子交换树脂发生置换,被绑定在柱子上,而组织胺-牛血清蛋白和组织胺-牛血清蛋白-Fc-IgG复合物就会被冲洗下来。最后通过电化学装置检测冲洗下来的组织胺-牛血清蛋白-Fc-IgG复合物浓度,进而计算出组织胺的含量。该方法用于定量仅需2 min,检测范围为200~2000 ng/mL[97]。
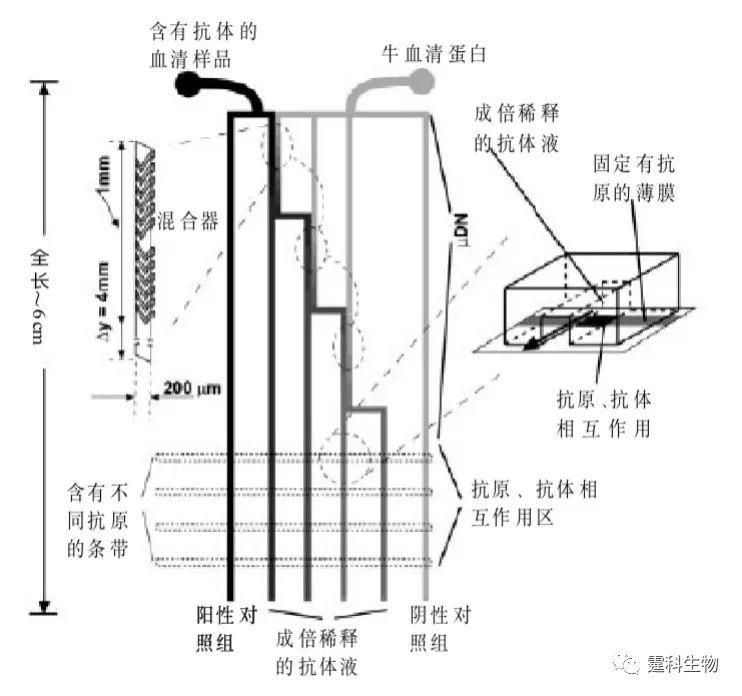
图6-69 阳离子交换柱免疫反应[97] (a)为具有2n个通道的柱子示意图;(b) 为芯片上电化学免疫反应的示意图 6.10.3.4 膜免疫反应 某些多聚物可被制成薄膜,具有不同孔径的薄膜可根据分子大小固定上不同的抗原(或抗体),用于选择性的绑定待测样品中的抗体(或抗原)。 图6-70是利用聚碳酸酯薄膜固定抗原测定艾滋病患者血清中IgG抗体浓度的酶联免疫吸附法示意图。在以聚碳酸酯为材料制成的孔径为200 μm的薄膜上固定上两条互相平行的艾滋病抗原带-gp41和-gp120,将此薄膜置于一表面平整的PDMS基片上,再把一条具有微通道的PDMS铸模封接在PDMS基片上,通过PDMS铸模的微通道引入不同浓度的患者血清,当血清流经固定在膜上的抗原带时,血清中的抗体(抗-gp41和抗-gp120)将被选择性的绑定在抗原上,再引入标有荧光的二抗来确定抗体的量。通过此方法测定的患者血清中抗-gp41和抗-gp120的平均值分别为2.0和1.0 mg/mL[98]。此方法可同时检测10~100种抗原或抗体,由于膜可以减少对流的发生,因此以膜作为固相载体比直接用通道表面作为固相载体更能减少交叉污染的发生。
图6-70 膜免疫反应示意图[98] 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |