|
|
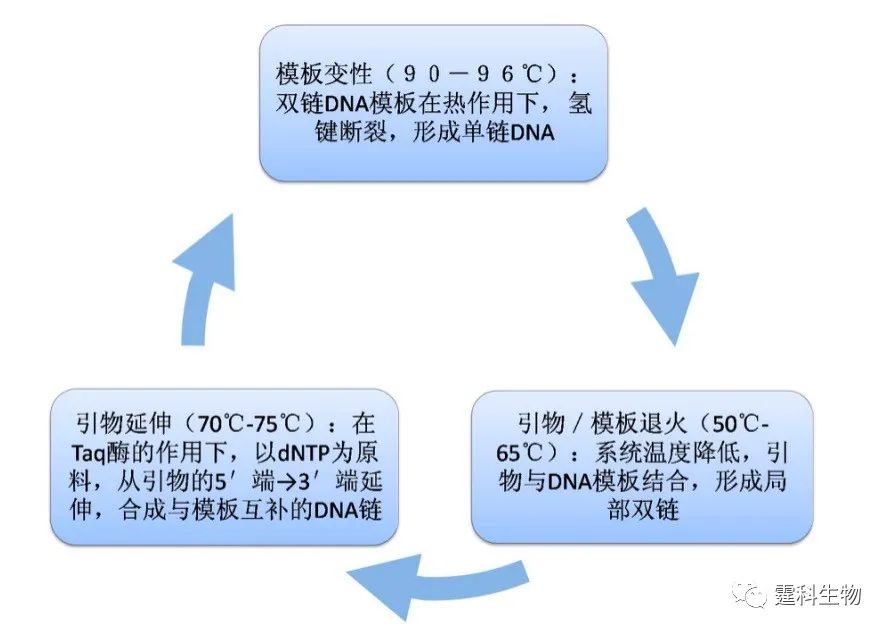
图解微流控|第17期发表时间:2021-10-29 14:07 微混合和微反应技术(三) 6.8 微型生物反应器 近年来,随着对微流控系统研究的深入,微流控芯片作为生物反应器的研究也越来越多。主要的应用对象有聚合酶链反应(PCR)、免疫反应、各类酶反应及DNA杂交反应等,本章将着重对PCR反应和免疫反应进行详细介绍。 6.9 聚合酶链反应(PCR) 聚合酶链反应(PCR)是一种在体外模拟自然DNA复制过程的核酸扩增技术,1985年由美国Mullis等人发明。它是一种无细胞扩增技术,通过引物延伸核酸的某个区域而进行的重复双向DNA合成,其灵敏度和特异性高,操作简便、快速,反应体系的设计简单并且有非常多的应用方式(如多重PCR、巢式PCR、竞争PCR、荧光定量PCR等),适用于各种不同的核酸样品。PCR技术在生物科研和临床应用中得以广泛应用,成为分子生物学研究中最重要的技术之一。 PCR扩增是一个在热循环条件下的酶催化过程,通过高温变性、低温退火及酶催化(适温延伸)三个过程的循环进行,使目的DNA片段得以迅速扩增,其过程简单示意于图6-34。
图6-34 PCR热循环过程示意图 理论上讲,每一循环经过变性、退火和延伸,DNA含量即增加一倍。但事实上,由于种种原因,理想的指数扩增很难达到,实际的DNA扩增公式如式6-1所示。 公式6-1:
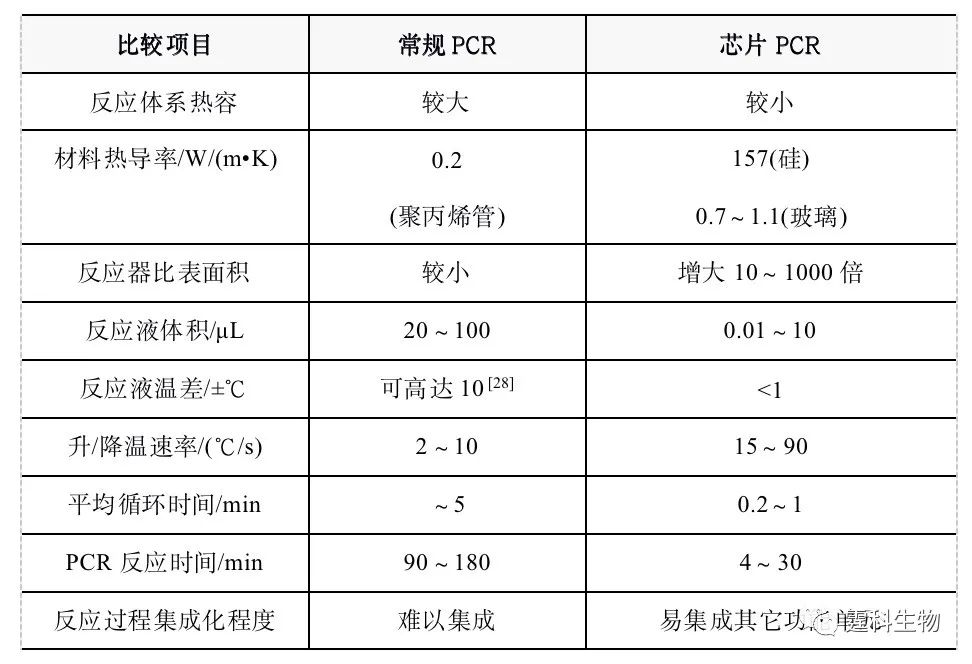
PCR扩增的关键是快速而准确地控制循环温度。已有多种商品化的热循环仪得到了广泛的应用。但是,因为一些技术上的缺陷,PCR扩增过程的速度和效率仍受到限制。有效扩增的首要条件是快速的热传递,因此,PCR本身要求扩增体系具有较低的热容,以便使反应体系进行快速的升/降温循环。 PCR三步循环中的每一步都有最短的有效反应时间,时间太长不仅浪费,还不利于Taq酶的活性。一般而言,常规PCR方法存在如下缺点: (1) 热容大,升/降温速率慢。常规热循环仪加热块的体积一般较大,所用聚丙烯反应管管壁的导热系数低,反应体积也较大,反应液的温度平衡时间较长(30~60 s),使整个反应时间增加。通常进行20~40次循环大约需要2~3 h。 (2) 反应液温度不均匀。加热块温度不均匀,反应管本身的几何形状及反应液较大的体积(20~100 μL),导致反应液中存在温度梯度。据报[28],标准PCR反应管上、下部平均温差有时可高达10℃,这必将引起非理想的链延伸,降低引物的退火效率和扩增的特异性。 (3) 较大的反应体积也增加了昂贵的生化试剂的消耗。 由此看来,减少PCR反应液的体积,可缩短循环时间,提高扩增产物的含量。但是,用常规的仪器操作极微小体积的样品实属不易。微流控芯片的通道尺寸为微米级甚至更低,流体通道封闭,易于实现pL级样品的操作。因此,利用微加工技术制作高效的PCR扩增仪已成为芯片实验室研究中的一个重要分支。芯片PCR,是指利用MEMS技术在硅、玻璃、高聚物等基片材料上加工一系列的微通道、微反应室等三维结构,再集成微阀/泵、微加热器/温度传感器等控制单元,实现芯片上快速、自动、高通量的PCR扩增。常规PCR与芯片PCR的比较见表6-2。 表6-2 常规PCR方法与芯片PCR方法的比较
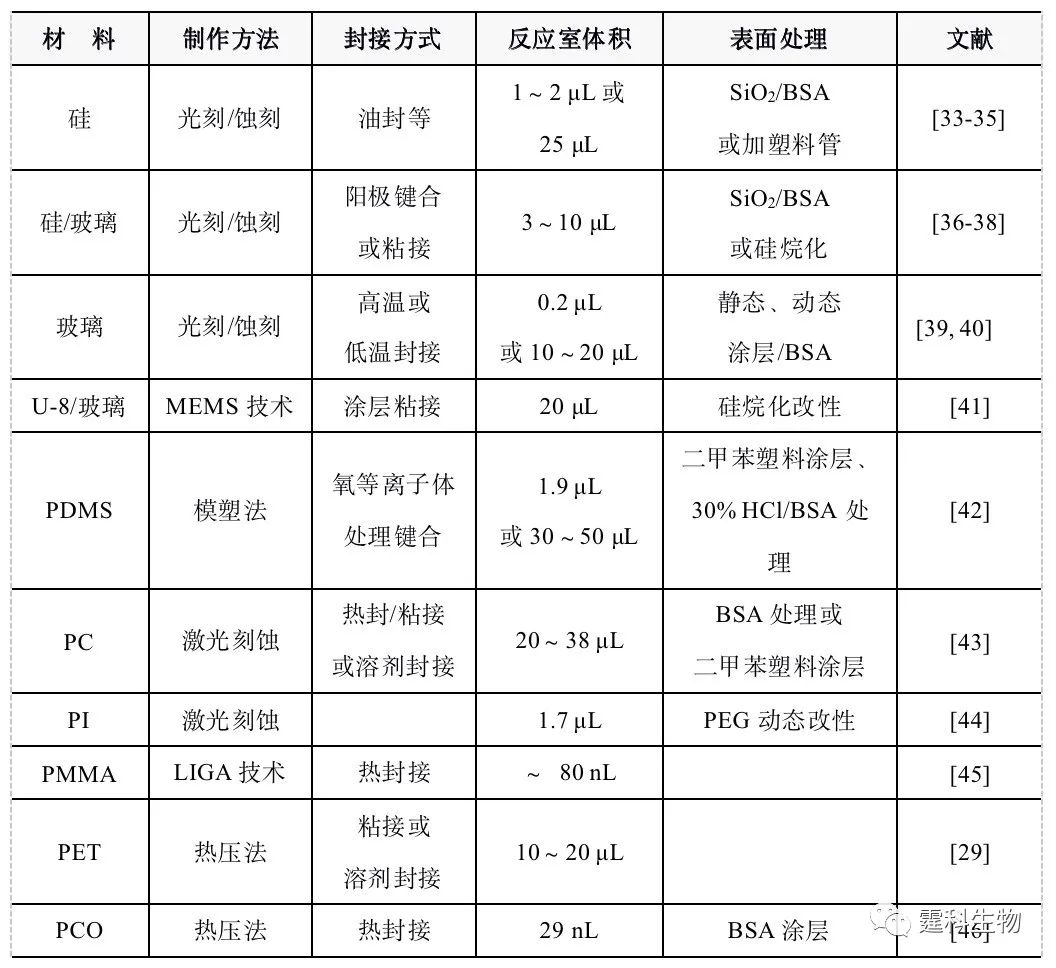
与常规PCR方法相比,芯片PCR方法具有一些明显的优点: (1) 热循环系统的体积减小,热容降低,升/降温速率大幅提高(一般为15~40 ℃/s,有的可高达60~90 ℃/s),反应时间成倍缩短; (2) 反应液体积减小,反应试剂的消耗降低,体系的热容减小,反应液温度的均匀性提高,热平衡所需的时间减少,扩增的特异性增强; (3) 微通道的比表面积较大(比常规反应管至少大一个数量级),同时可选用导热系数高的材料,加快热传递速率,进一步减少反应液温度的平衡时间和PCR循环时间; (4) 易于集成化和功能化。 6.9.1 PCR芯片的制作 芯片PCR技术发展至今,用于制作PCR芯片的材料多种多样,图6-35展示了几种不同材料的PCR芯片。因尺寸的微型化,芯片表面的化学行为显得更为重要。
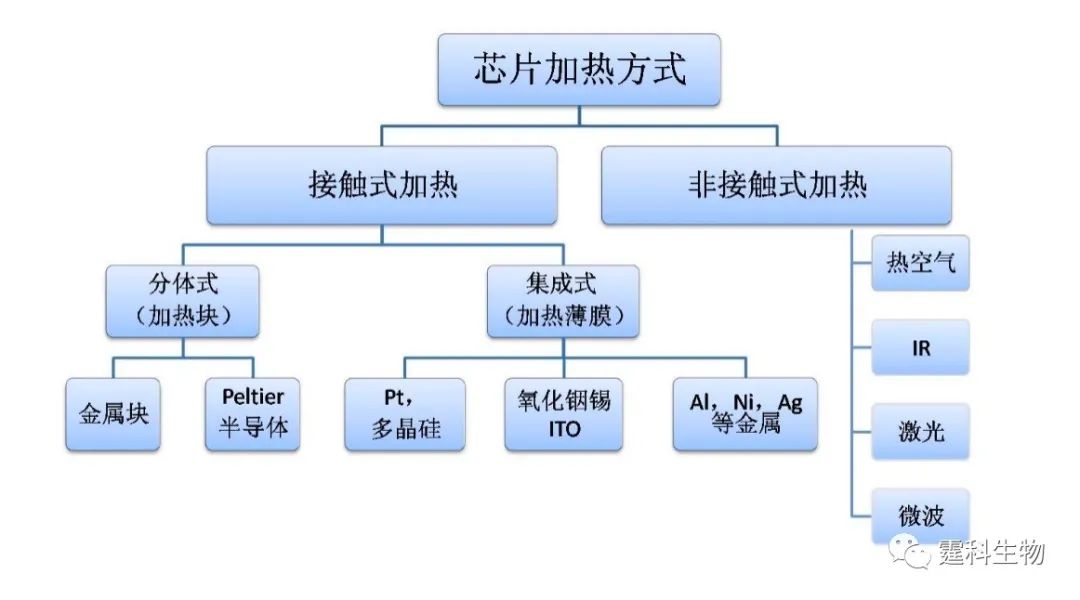
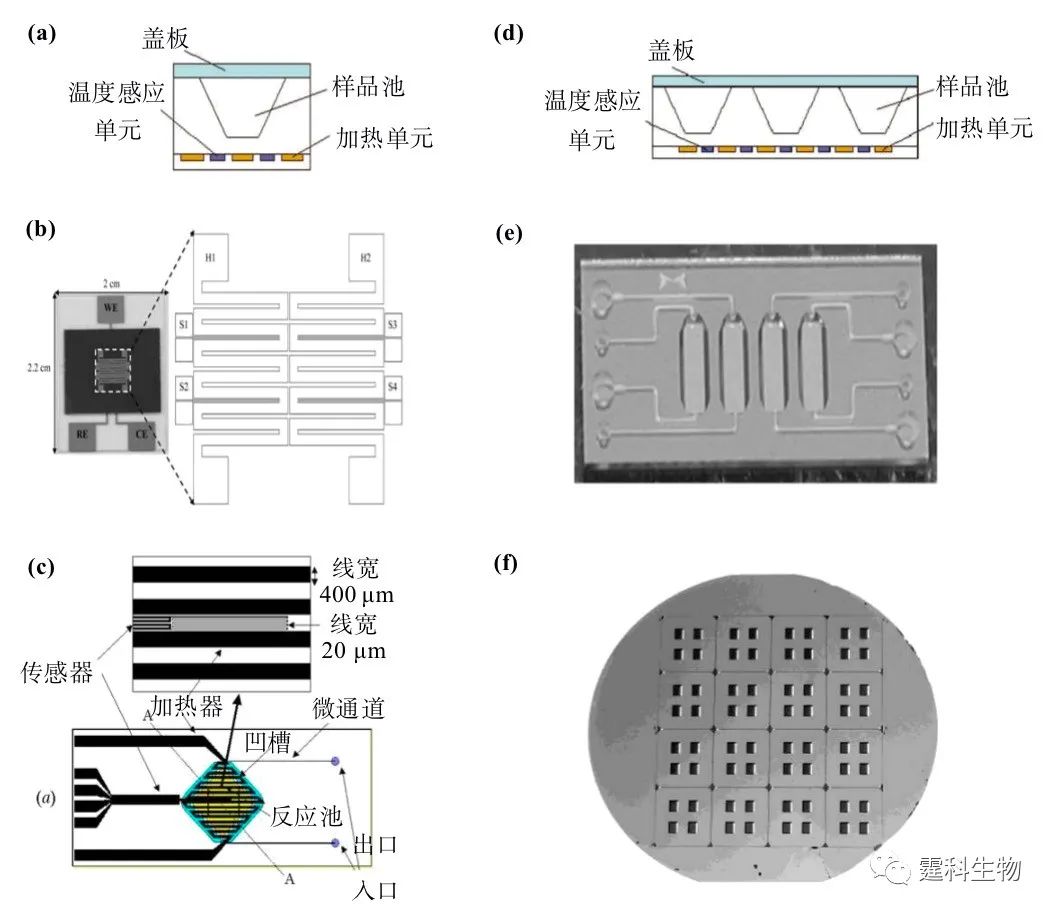
图6-35 不同材质的PCR微芯片 用不同材料制作的PCR微芯片的基本性能及其表面处理方法的扼要比较见表6-3。 从表6-3中可以看出,PCR芯片与一般的芯片制作工艺基本相同。它们的主要区别在于加热/控温装置的制作。根据PCR芯片加热方式的不同,可分为图6-36所示的几类。 表6-3 不同材质PCR微芯片的比较
注: PDMS为聚二甲基硅氧烷;PC为聚碳酸酯;PI为聚酰亚胺;PMMA为聚甲基丙烯酸甲酯;PET为聚对苯二甲酸乙二酯;PCO为聚环链烯烃
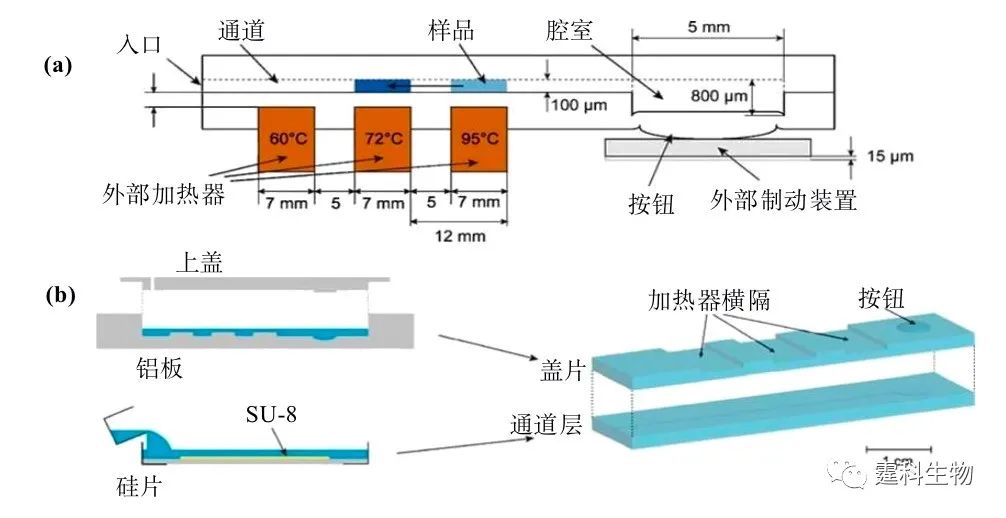
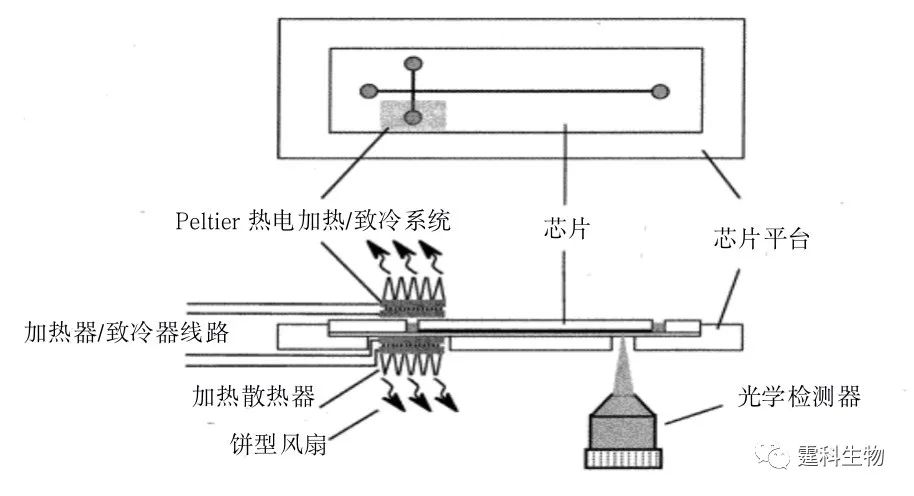
图6-36 PCR芯片加热方式分类 6.9.1.1 接触式加热 现有芯片PCR系统大多采用接触式加热方式,主要可分为分体式和集成式两种。最简单的是利用电热加热导热性好的铜块[47-50]或铝块[51]。图6-37所示的芯片盖片由PDMS浇注于三维铝制模具中压制形成,下层由SU-8在硅片上形成通道结构,浇注PDMS形成通道,两层通过氧等离子体封接,最后将铜块嵌入盖片凹陷处进行加热[50]。另一种则如图6-38所示,采用Peltier热电加热/致冷系统(或另加风扇致冷),并配合热电偶等测温元件控温[40, 51]。此外还有直接用常规PCR仪进行扩增的例子[52]。在上述分体式芯片PCR中,加热/测温元件与芯片是分离的,加工简单,价格便宜,但热容大,升降温速度较慢,系统体积较大,不便于整体微型化。
图6-37 金属块加热式PCR芯片[50] (a)芯片横截面示意图;(b)芯片制作示意图
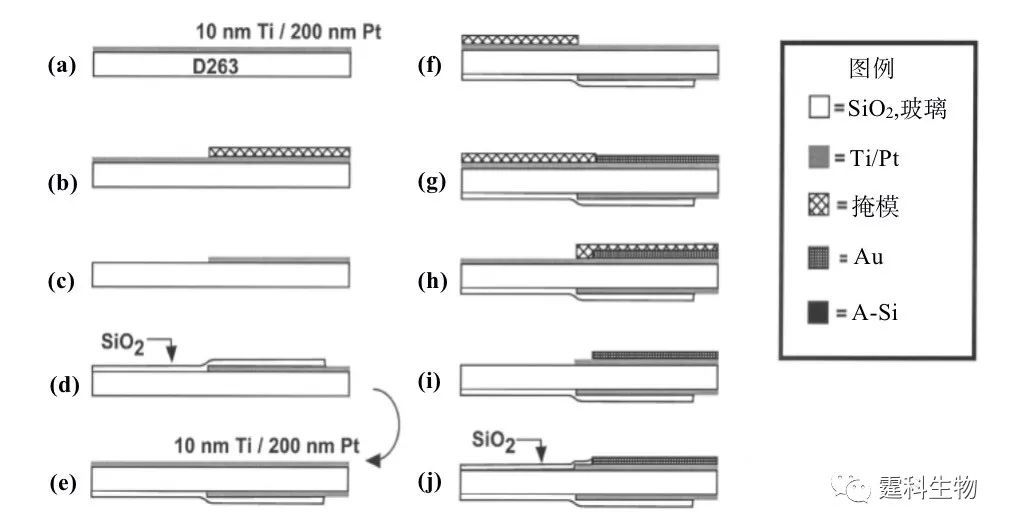
图6-38 双Peltier热循环系统结构示意图[40] 相对于分体式芯片PCR,集成式芯片PCR更能体现微流控芯片实验室的集成化优势,一般是在PCR芯片上集成薄膜微加热器和电阻式温度检测器(RTD),再通过连接到外部的控制电路来实现对反应区的温度控制[36, 51-56]。薄膜加热器/温度传感器尺寸小,热容和能耗均低,响应速度快,可集成化程度高。通常是在硅或玻璃芯片微反应室底部制作微加热器/温度传感器,主要有两种方法:一种是用扩散掺杂工艺;另一种则是采用金属薄膜工艺加工,最常用的金属是铂(Pt),一般在微反应室底部沉积一层钛(10~30 nm)和一层铂(100~300 nm),然后刻蚀出所需的图形作为金属薄膜加热器/温度传感器。这里的钛作为附着层存在,其作用是实现金属铂与硅或玻璃的良好接触,也可以用铬来代替。氧化铟锡(ITO)由于透光性好,不影响检测,因此也常被溅射到玻璃基片上,通过光刻技术形成加热器和温度传感器[56]。图6-39详细展示了PCR-CE芯片加热器/温度传感器的制作流程[36]:(a)在D263 玻璃片的一面溅射10 nm Ti 和200 nm Å Pt;(b)覆盖掩模,曝光,形成图形;(c)用王水(HCl:HNO3=1:3,90°C)刻蚀,形成RTD单元;(d)用等离子体化学气相沉积法在此面沉积200 nm SiO2;(e)在玻璃片的背面溅射10 nm Ti 和200 nm Pt;(f)覆盖掩模,曝光,形成图形;(g)在曝光的Ti-Pt层表面电镀5 mm的Au;(h)移动掩模,曝光,在另一侧形成图形;(i)利用阳离子刻蚀系统在Ti-Pt层刻蚀出加热单元;(j)用等离子体化学气相沉积法在加热元件和导线部分沉积300 nm SiO2。
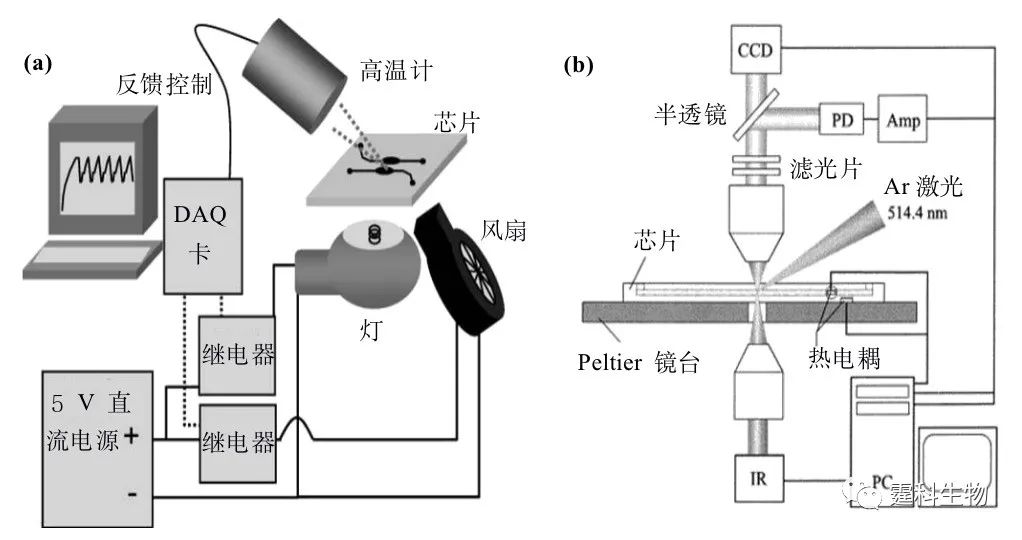
图6-39 PCR-CE芯片加热器/温度传感器制作流程图[39] 6.9.1.2 非接触式加热 由于接触式加热大多采用加热源与PCR反应室直接接触,热循环时必须对整个系统加热和冷却,因此会大大增加整个反应体系的热容,限制PCR反应的热循环速率,降低反应的特异性和反应效率。非接触式加热方法则可以避免上述问题,有效提高热交换速率。常用的非接触热源有热空气[59]、红外线[30, 44, 60]、激光[61, 62]、微波[63, 64]等,图6-40为其中几种仪器构架示例。
图6-40 几种非接触式加热PCR仪器构架图 (a) 钨丝灯加热(红外线)[60];(b) 激光加热[62] 6.9.2 芯片PCR反应分类 根据芯片设计和热循环方式的不同,芯片PCR技术主要分为反应液静止式和反应液流动式两种。在静止式芯片PCR中,各种反应都发生在有限的空间里,温度周期性变化;而在流动式芯片PCR中,通过反应液连续流经三个不同的恒温带而实现样品的扩增。 6.9.2.1 反应液静止式 反应液静止式芯片PCR,又称为时域PCR,实际上是传统PCR的微型化。这种装置中,反应混合物通常被固定在微反应室内,在外部或内部控制加热器的温度实现快速升/降温,完成一轮PCR的三个温度循环。图6-41中列举了各种反应液静止式PCR芯片。这种方法热循环次数不受限制,芯片尺寸小,可根据不同需要设计不同的微反应室[36, 65-68]或者反应室阵列[38, 69],进行高通量PCR扩增,便于微型化和便携化;其关键是精确而快速的升/降温循环,因而需要对PCR系统的热容进行相当程度的优化,以缩短反应时间、减少能量消耗。
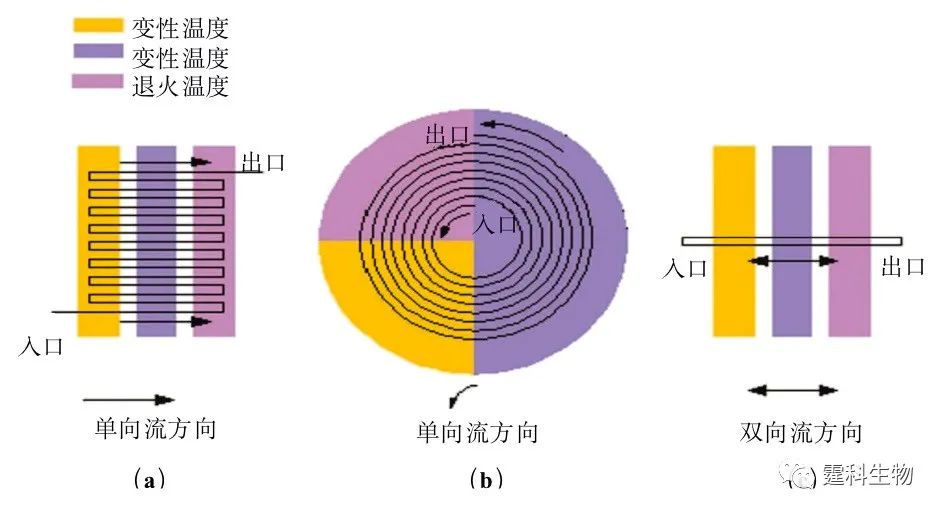
图6-41 各种反应液静止式PCR芯片 (a) 单反应池PCR芯片示意; (b-c) 单反应池PCR芯片实例 [36, 68] ;(d) 多反应池(阵列)PCR芯片示意; (e-f) 多反应池(阵列)PCR芯片实例[38, 69] 6.9.2.2 反应液流动式 反应液流动式芯片PCR,一般称为连续流动式PCR,也称为空域PCR。如图6-42所示,在这种PCR中反应混合物在微通道中连续反复流经三个不同的恒温区,从而达到DNA片段热循环扩增的目的[70]。该方式通过时间和空间的转换实现PCR扩增,即样品在每个温区停留的时间取决于样品的流速和该温区内微通道的路径设计。由于通道壁的温度维持恒定而只改变流动液体的温度,因而变温迅速、温度控制相对简单,液体反应物蒸发小,而且在保证一定的扩增效率的前提下,反应体积可变,因此,有可能利用不同的流动控制方法进行单个或多个样品的连续扩增。但这种方法的热循环次数由芯片设计决定,不便于灵活控制;同时,较大的芯片空间也不利于和其他微流控单元集成。
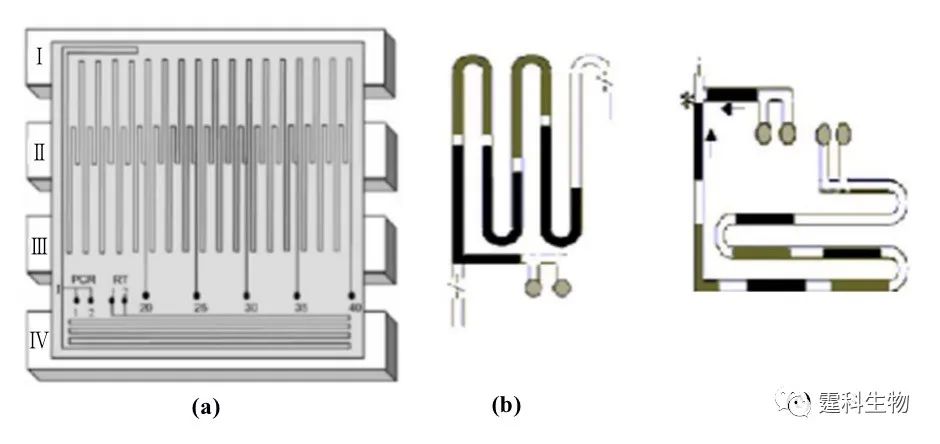
图6-42 反应液流动式芯片PCR的几种主要类型[70](a)逶迤式[47, 71];(b)螺旋式[49];(c)往复式[50, 56, 72] 图6-43中是集成了反转录(RT)与 PCR 过程的连续流动式PCR 芯片[71]。该芯片包括Ⅰ、Ⅱ、Ⅲ、Ⅳ四个恒温区,其中Ⅰ、Ⅱ、Ⅲ、用于 PCR 反应,Ⅳ用于 RT 反应,该芯片能灵活选择热循环次数(20~40次);这一实验也证明了在同一微通道中以连续流动的方式同时进行多个RT反应和PCR反应的可行性。
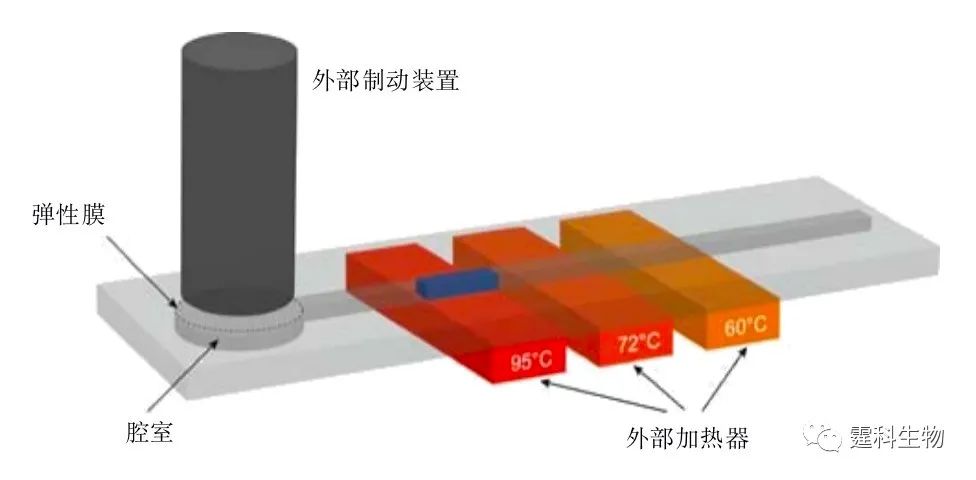
图6-43 集成反转录和PCR的连续流动式PCR芯片[71] (a)芯片结构图;(b)多个样品同时进行PCR反应;(c)多个样品同时进行RT反应 通常,连续流动式 PCR 芯片所占空间较大,热循环次数较难控制,不利于微芯片的集成和应用。可通过流体双向驱动系统和光学定位系统,控制反应液在不同的恒温区之间来回反复流动而实现热循环反应[48, 54, 70],减小所需微通道的长度,控制循环次数。图6-44所示的装置[48]就利用了外部制动装置、弹性膜和腔室实现了反应液的往复驱动,通过控制流体循环流动的速度和次数,能方便的控制PCR反应的时间和循环次数。此外,在体积较小的闭环通道中,还可分别利用芯片上集成的阀和泵[53]、外接蠕动泵[71]、同步式电驱动[49]或热虹吸效应[72]等方式,使反应液不断循环流过不同的恒温区进行扩增。
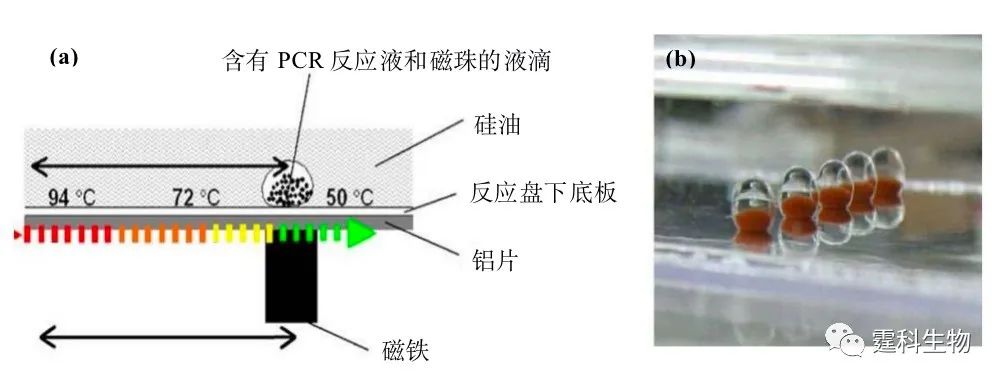
图6-44 往复式连续流动式PCR[50] 图6-45为一种阵列的往复式液滴连续流动PCR的示意[75]。作者将含有磁珠的PCR反应液滴放入注满硅油的平盘反应器中,液滴随反应器下的磁铁在50-94 ℃的温度梯度间往复流动而实现热循环反应。该系统可在 11 min内(30个循环)完成5个不同长度的DNA片段的同时扩增。特别是,他们还在 3.6 min内(40个循环)实现了人类常见GAPDH基因的快速扩增。
图6-45 阵列往复式液滴连续流动PCR[75] (a) 液滴运动示意图;(b) 液滴阵列放大图 6.9.3芯片PCR集成 微流控芯片实验室的一个重要特征是将多种操作单元,如样品纯化/萃取、扩增、分离、检测等集成到一块芯片上,集成化才能充分体现其低能耗、高通量、自动化的优势。下面将介绍几种主要的集成式芯片PCR。 6.9.3.1样品纯化单元与芯片PCR单元的集成 在硅/玻璃PCR芯片的微反应室中刻蚀出“围堰型”的微过滤器(见图6-46),可以从全血中分离出白血细胞,通过控制“围堰”的高度和形状,可选择性的分离不同大小的细胞,直接进行PCR扩增,由此将核酸分析中两个重要的样品处理过程—细胞分离和PCR扩增,集成到同一块芯片上[76]。
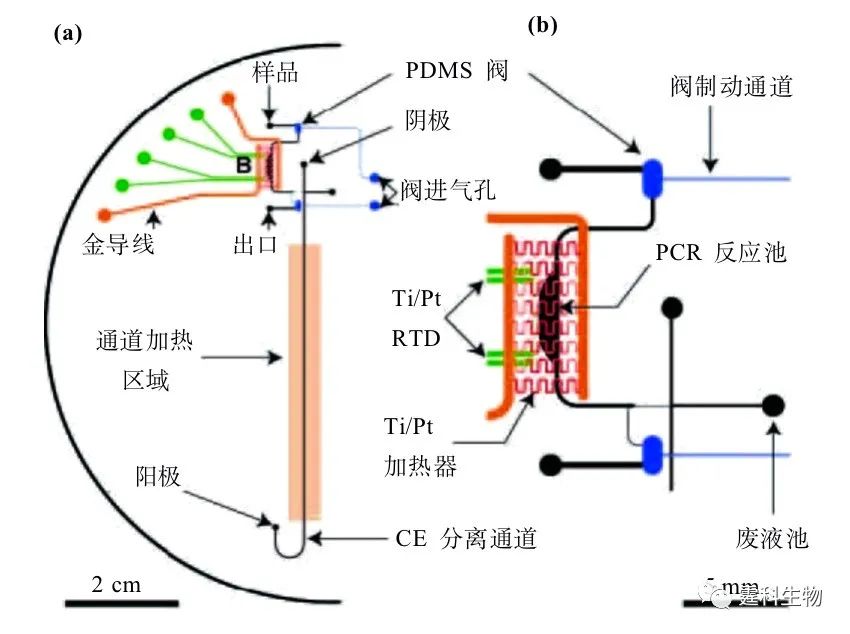
图6-46 集成微过滤器PCR芯片[76] 6.9.3.2芯片PCR单元与分离/检测单元的集成 ① 芯片PCR与芯片电泳的集成 Mathies小组较早将芯片PCR和芯片电泳两个过程集成到同一芯片上[53],虽然还不是真正的单芯片集成系统,但它证明将两者集成在一起的可能性。近期,该研究组采用微加工技术制作出集成有铂薄膜微加热器/温度传感器以及PDMS微阀的PCR/CE集成芯片系统[77](见图6-47),进行了短串联重复序列的基因分型,提高了升/降温速率,降低了功耗及反应时间。
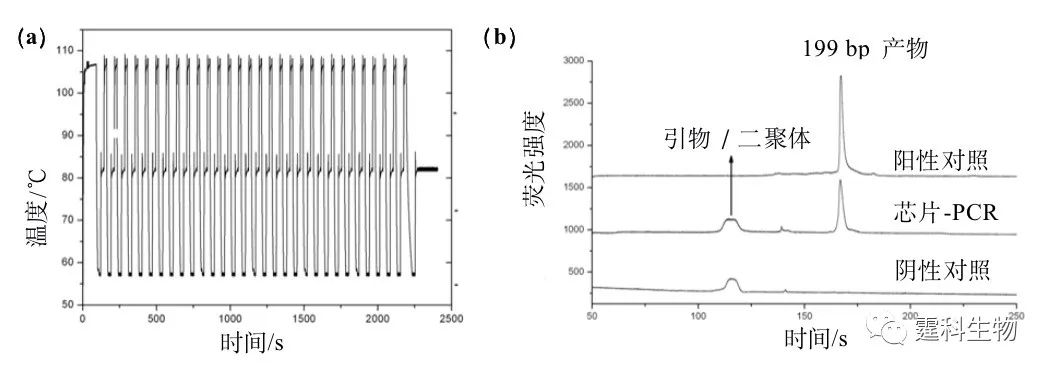
6-47 集成微加热器/传感器及PDMS微阀的PCR/CE芯片[77] (a) 芯片设计图;(b) PCR区域局部放大图 作者所在的研究组曾设计、制作了集成PCR反应池和电泳微通道的玻璃芯片以及相应的芯片PCR扩增仪[52, 78],该仪器使用两套Peltier热电加热元件和热电偶并配合致冷风扇,在芯片的上、下两面同时进行双向加热与致冷。研究组在该芯片上成功地进行了SARS病毒基因的RT-PCR和多重PCR扩增,并利用自制的微流控芯片电泳仪进行芯片电泳/激光诱导荧光(LIF)检测[52],结果表明:该方法可靠、迅速,样品消耗低,优于常用的PCR扩增-凝胶电泳检测方法。在此基础上,研究组将铂薄膜微加热器/温度传感器集成到PCR/CE芯片 的同一面(见图6-48),因此只需进行一次金属镀膜、刻蚀和氧化硅涂层,即可得到集成化的微型温控元件[79]。这种方法不仅降低了芯片的制作难度和成本,也缩短了芯片的制作周期,是对芯片PCR方法集成化和实用化的有益的探索。利用该集成PCR芯片和自制温控电路,通过快速温度循环(45 s/循环),成功得到了199 bp的λ-DNA扩增产物(图6-49)。
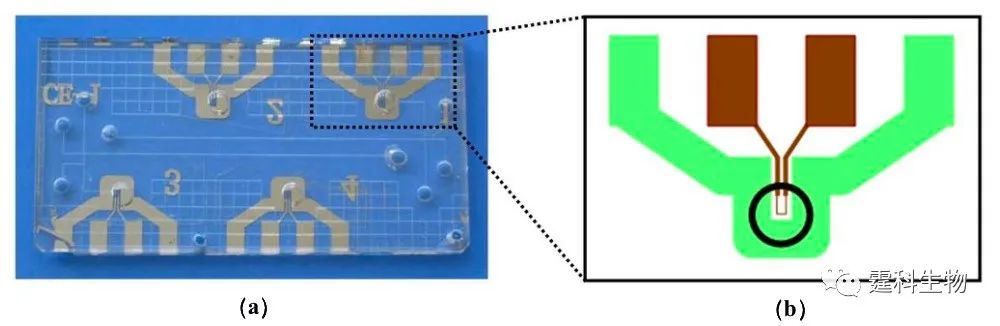
图6-48 集成PCR-CE芯片[79] (a)芯片实物图,其中包含两个PCR单元和两个PCR-CE单元;(b) PCR区域局部放大图
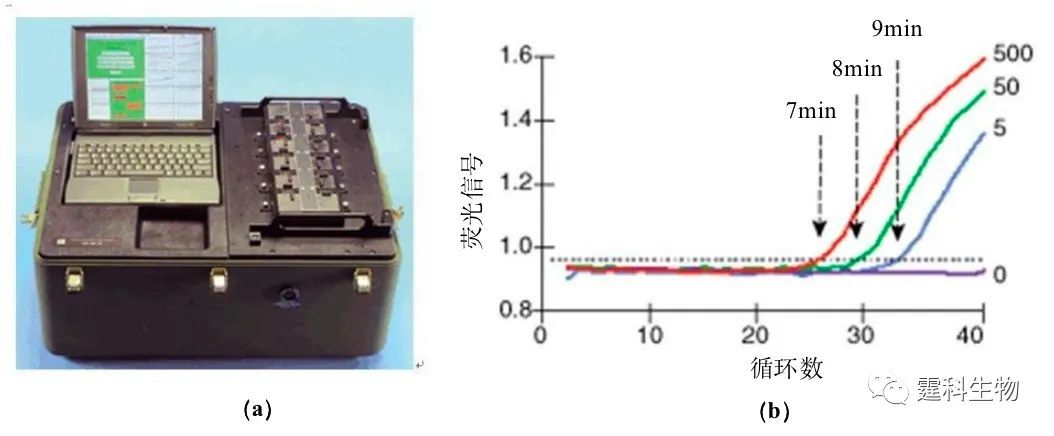
图6-49 芯片PCR结果图 (a) “两步法”芯片PCR温度循环图,45 s/循环;(b) 芯片及常规PCR 产物电泳图 ② 芯片PCR与检测单元的集成 PCR芯片本身体积微小,要求相应的检测系统也应该微型化、集成化;随着此领域研究的深入,出现了各种集成检测器系统的PCR芯片[80,81]。图6-50是一种以电池为电源,像公文包大小的便携式实时荧光芯片PCR分析仪[81],该仪器中PCR硅芯片不仅集成了薄膜加热器和光检测窗口,而且将基于二极管的整套固态光学检测系统集成到同一芯片上,使该系统无可移动的光学器件,采用TaqMan荧光探针,据称可在7 min内(17 s/循环)检测出E.herbicola细菌[81]。
图6-50 集成化实时荧光芯片PCR仪[81] (a) PCR仪照片;(b) 不同克隆数量的E.herbicola细菌快速实时定量PCR分析结果 6.9.3.3含有多个操作单元的芯片DNA分析系统的集成 集成了多个功能单元和多步操作过程的DNA分析芯片系统近年来也陆续有所报道。 ① 高度集成的nL级DNA分析芯片系统 图6-51所示系统包括nL级的液体进样通道、样品计量混合通道、用于液体样品定位的疏水通道、可控温的反应室、电泳分离通道和荧光检测器。除激发光源、压力源和控制电路部分外,其他部分通过光刻/蚀刻技术集成在硅/玻璃芯片上[82]。
图6-51 高度集成的nL级DNA分析芯片系统[82] ② 高度集成的多步基因分析芯片系统 图6-52中的系统可对fmol级的DNA自动进行一系列复杂的基因分析操作: PCR扩增、捕获/纯化、高分辨率测序。芯片由玻璃和PDMS杂合而成,其上集成隔膜微阀和薄膜加热/传感器。利用该芯片,可以对1 fmol的DNA模板进行扩增、纯化和测序,测序长度可达到556个碱基(检出率99%)[83]。
图6-52 集成化DNA扩增/纯化/测序系统[83] ③ 集成多步反应过程的DNA分析芯片系统 可通过集成的微泵和微阀等功能单元的控制,将涉及到DNA分析的一系列反应过程集成到同一芯片上,从而能在芯片上完成比较复杂的基因分析操作。例如,可将逆转录(RT)过程和PCR过程集成到PDMS/玻璃芯片上[84](见图6-53),形成一种便携式的RNA病毒检测芯片系统;也可将PCR过程、DNA酶解过程和电泳过程集成在一起[85],该研究展示了这种芯片系统在基因分析领域广阔的应用前景。
图6-53 集成逆转录(RT)过程和PCR过程的芯片示意图[84] ④ 全集成的DNA分析芯片系统 图6-54所示的PC芯片[86]上集成了气动微流混合器、热启动石蜡微阀、电化学微泵/热气动泵、微加热器和DNA微阵列,无须外加压力源、流体储存室、机械泵和阀,即可对复杂的生物样品进行一系列分析,如细胞捕获/浓缩/纯化/裂解(利用表面改性磁珠)、DNA扩增、DNA杂交及电化学检测,从而减少样品被污染的可能性,并简化操作过程。利用该芯片系统可从几毫升的全血样品中检测致病菌,也可直接对稀释的血样进行单核苷酸多态性(SNP)分析。该系统提供了一个直接从输入样品到输出相关基因信息的可行的解决方案。
图6-54 样品纯化/DNA扩增/杂交检测全集成的DNA分析芯片[86] 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |