|
|
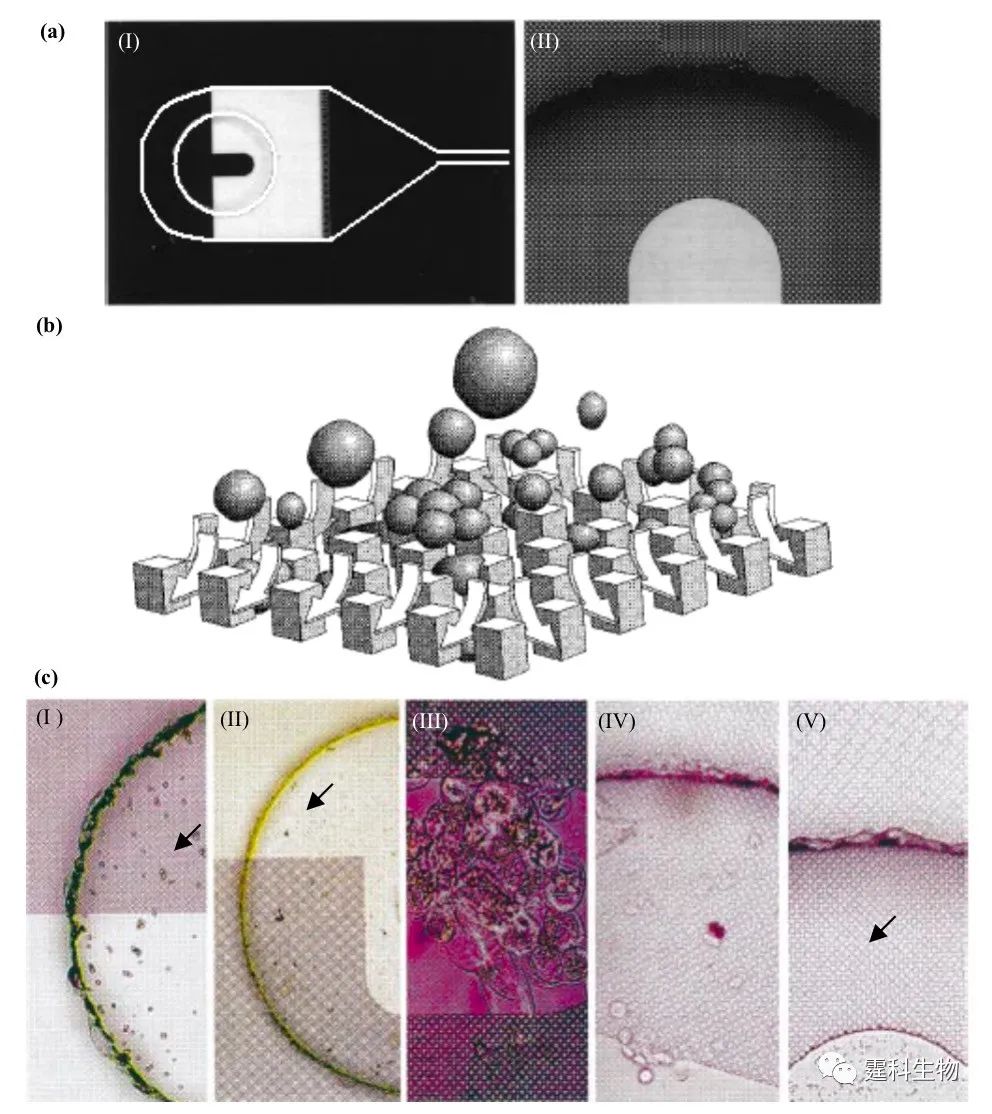
图解微流控|第14期发表时间:2021-10-15 13:17 进样和样品预处理技术(三) 5.5 过滤 过滤(filtration)是一种用于除去液态样品中颗粒状干扰物的预处理手段。若以导管模式将液态样品引入芯片中,仅需在样品源和芯片间加入一个滤头即可对样品实施过滤预处理操作。若以储液池模式将液态样品引入芯片中,则需在芯片上集成过滤装置。在储液池内加工出微柱阵列就可以实现这种集成化的过滤装置[29],如图5-21所示。
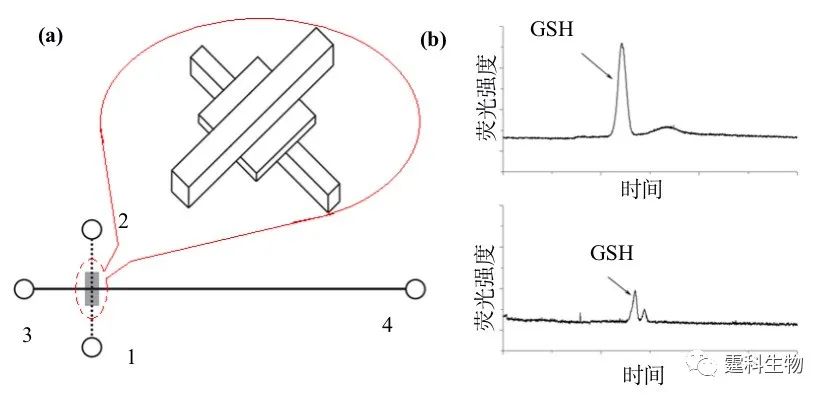
图5-21 芯片过滤展示 (a) 集成在储液池内的过滤操作单元,(I)内含微柱阵列储液池的照片 (II)微柱阵列部分放大图片;(b) 微柱阵列过滤原理;(c) 微柱阵列捕捉各种颗粒,(I)5 μm直径的硅球,(II)缓冲液残渣,(III)真核大豆细胞,(IV)人类KB癌细胞,(V)大肠杆菌 5.6 膜分离 在很多实际应用中,需要按分子量的大小把溶液中的各种分子分离。这种情形往往依赖选择性透过膜,依靠外界能量(压力、离心力及电位差等)或化学位差(浓度差等),大小分子可以分居膜的两侧,实现分离,在分离的同时,大分子物质往往还可在膜的一侧富集。依赖外界能量的膜分离操作通常称为膜过滤,依赖化学位差的膜分离操作通常称为渗析,它们都已在芯片上成功实现。 5.6.1 膜过滤 过滤技术的集成是近几年微流控芯片研究的一个热点,从已有文献报导来看,微过滤器的形式可谓多种多样,常见的有围堰式、栅栏式、阵列式及多孔膜式等。其中以多孔膜结构为基础的膜过滤最具吸引力,与其它几类只能截留较大颗粒或细胞的微过滤器相比,膜过滤具有更好的选择性,通过控制膜孔径的大小,它可以实现分子水平的分离。在微流控芯片上,多孔膜结构的引入可归纳为两种方法:一是借助于商品化的微孔滤膜,二是通过精细加工技术直接在微通道内加工出多孔膜。 作者课题组以商品化的微孔滤膜为基础,成功地将膜过滤预处理单元与后续的电泳分离单元集成于同一块芯片上,既可用于复杂体系中小分子的选择性进样(图5-22),也能在电泳分离前对大分子物质进行纯化和预富集(图5-22)。 图5-22(a)是用于测定小分子物质的微孔滤膜多层PDMS芯片结构示意[30,31](虚线和实线分别代表上下层通道,阴影部分代表膜),(b)为在该芯片上得到的血浆(上)和红细胞裂解液(下)中还原性谷胱甘肽(GSH)的测定谱图(该图是直接进样的芯片电泳图,而这两种样品在普通玻璃芯片上直接进样时,由于蛋白质和细胞碎片的影响,基线变得极不稳定,有大量毛刺产生而不能完成测定)。图中1为样品池,2为样品废液池,3为缓冲液池,4为缓冲液废液池。电压首先加在1,2池之间使样品充满上层通道,然后加在1,4池之间一段时间,小分子样品便穿过膜进入下层通道形成一段区带,最后电压加在3,4池间,进行电泳分离。
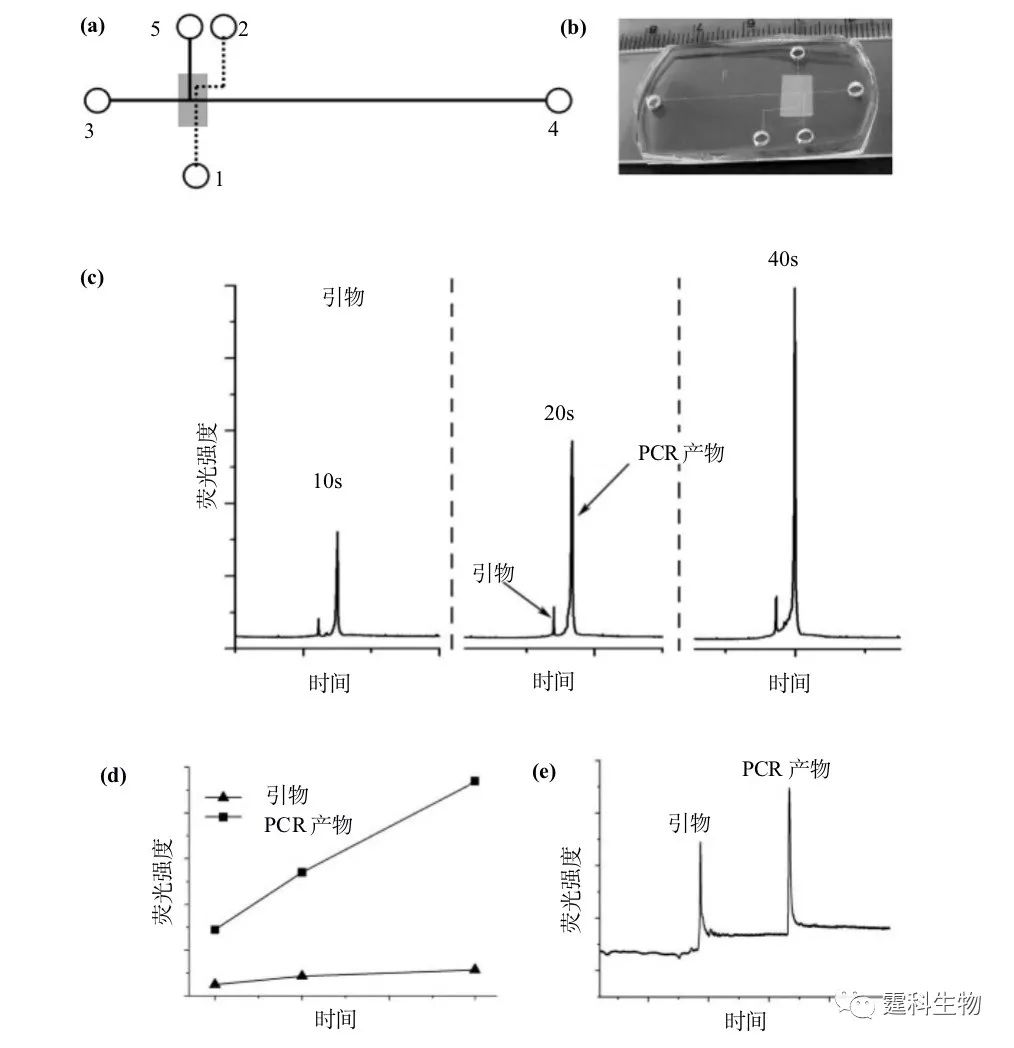
图5-22 芯片膜过滤用于复杂体系中小分子的选择性进样 图5-23为芯片膜过滤用于大分子的纯化和富集,其中(a)为用于测定大分子物质的微孔滤膜多层PDMS芯片结构示意[30](虚线和实线分别代表上下层通道,阴影部分代表膜),(b)为芯片实物照片,(c)为DNA样品(引物与411 bp PCR产物)经不同进样时间富集后所得的芯片电泳图,(d)为峰高随进样时间的变化趋势,(e)为不带膜过滤操作单元的普通玻璃芯片上所得的同一样品电泳谱图。其中,1为样品废液池,2为缓冲液池,3为缓冲液池,4为缓冲液废液池,5为样品池。电压首先加在5,1池之间使大分子样品在十字交叉口膜下堆积,然后加电使3,4池的缓冲液从下层芯片流向上层的1池,从而压缩膜下堆积的大分子样品区带,最后电压加在3,4池间,进行电泳分离。 图5-23(c)说明了该芯片对PCR产物的富集和纯化效果,随着进样时间的增加,PCR产物峰的峰高显著增加,而分子量较小的引物峰峰高则变化不大。与普通芯片分离结果(5-23(e))相比较,引物峰的强度明显减低,经过40 s富集后的产物峰强度增加了~80倍。
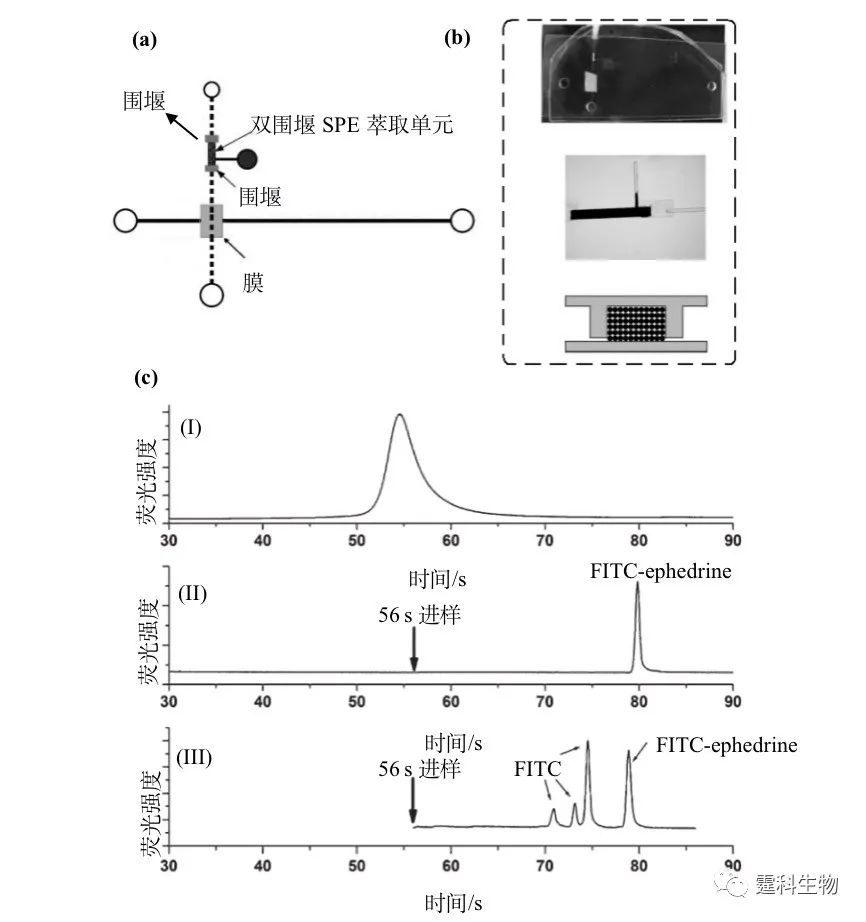
图5-23 芯片膜过滤用于大分子的纯化和富集 膜过滤因选择性透过膜的阻隔作用可在膜的一侧富集大分子,但在许多实际情形中,需要富集的是小分子,此时可在图5-22所示芯片上再插入一个固相萃取单元(SPE)以实现此目的,作者课题组相应的工作如图5-24所示。 图5-24所示为集成膜的芯片装置用于小分子的富集和测定:(a)为用于测定小分子物质的SPE-微孔滤膜多层PDMS芯片结构示意[32](首先在上层通道内进行SPE过程除去FITC杂质并富集FITC-ephedrine,然后将处理后的样品引入下层通道进行电泳分离);(b)为自上而下,芯片实物照片、SPE柱照片和双围堰结构示意图;(c)为(FITC-ephedrine+FITC杂质)样品的分析,其中(I)为预实验,考察FITC-ephedrine洗脱后到达膜区域的时间;(II)为在该时间进样得到的电泳谱图,由于SPE除杂的作用,谱图中没有FITC杂质峰,FITC-ephedrine被富集~103倍;III为未偶联SPE的微孔滤膜多层PDMS芯片上得到的分析谱图。 图5-24所示芯片的优点在于,膜的介入使SPE萃取和芯片电泳分别在芯片的不同层内进行,双方可互不干扰。这为其他种类芯片样品预处理单元和样品处理单元的偶联提供了一条切实可行的思路。需特别提及的是仅当电场存在时,芯片上下两层才互相连通。
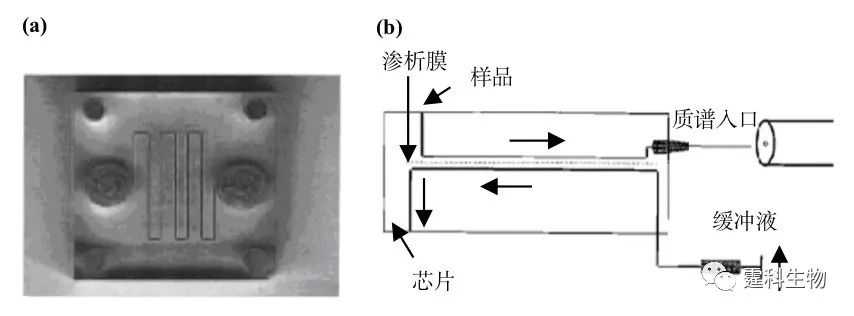
图5-24 集成膜的芯片装置用于小分子的富集和测定 5.6.2 渗析 所谓渗析(dialysis),是指在半透膜两侧组分间浓度梯度驱动下,小分子量物质从膜的一侧扩散至另一侧溶液,大分子量物质则因不能透过半透膜而被截留在原溶液中,从而使原溶液中的大小分子得以分离的一项膜分离技术。渗析膜通常由纤维素酯或再生纤维素等材料制成,截留分子量从100 Da至300 kDa不等。在芯片上集成渗析膜通常采用“三明治”手段,在两片带通道的塑料芯片(材质包括聚碳酸酯,聚亚酰胺,PDMS等)间夹入一片渗析膜,通过机械固定或其他手段使之对齐并紧密封接在一起(图5-25)。
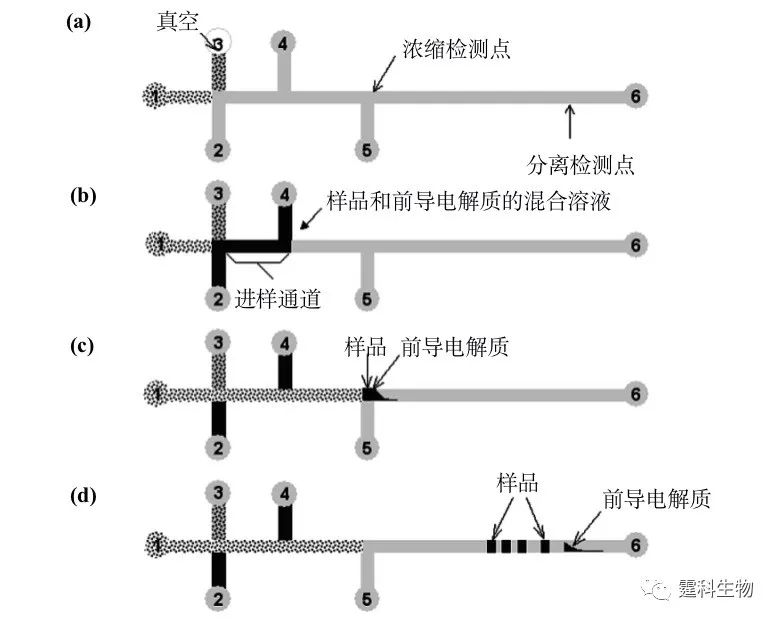
图5-25 一种用于马心肌红蛋白质质谱前脱盐的三明治式微透析聚酯芯片[33] (a) 三明治式微透析聚酯芯片照片;(b) 脱盐原理示意图 脱盐意指去除小分子干扰物。为最大限度提高芯片脱盐效率,通道被制成逶迤形以增加长度且缓冲液通道远宽于试样通道,并在渗析时使渗析缓冲液与样品逆向流动。经在该芯片上的在线提纯,马心肌红蛋白质谱峰的信噪比提高了40倍 5.7 等速电泳 等速电泳(isotachophoresis,ITP)是一种基于离子淌度差异的“移动边界”电泳技术,它采用两种不同的缓冲液系统,一种称为前导电解质,充满整个芯片通道,另一种是尾随电解质,置于一端的储液池,前者淌度高于任何样品组分,后者则低于任何样品组分,被分离的组分按其不同淌度顺序排列在其中,以同一速度迁移。 等速电泳具有富集功能。这种富集功能归因于一种“区带浓缩效应”,指的是组分区带的浓度由前导电解质决定,一旦前导电解质浓度确定,各区带内离子的浓度亦即为定值,如果此时某一组分离子浓度较小,就将被“浓缩”。浓缩倍数通常从几十倍至几百倍不等。作者所在课题组将等速电泳预处理单元与后续的电泳分离单元集成于同一块芯片上,实现了蛋白质的富集和分离[34,35](图5-26)。 图5-26中,1为尾随电解质池,2为废液池,4为样品池,3、5和6为背景电解质池,图中所示过程基于如下假设,样品由正极迁移至负极。(a)为背景电解质和尾随电解质的注入,(b)为样品和前导电解质混合溶液的进样—4号池接地,2号池高压,(c)为样品浓缩—1号池接地,6号池高压;(d)样品分离—5号池接地,6号池高压。该芯片在实际操作过程中无需任何泵和阀,只需5个电极便可控制样品的进样、浓缩和分离。以四个荧光标记的标准蛋白质为样品测试该芯片性能,与常规的十字通道进样比较,样品被浓缩40倍。
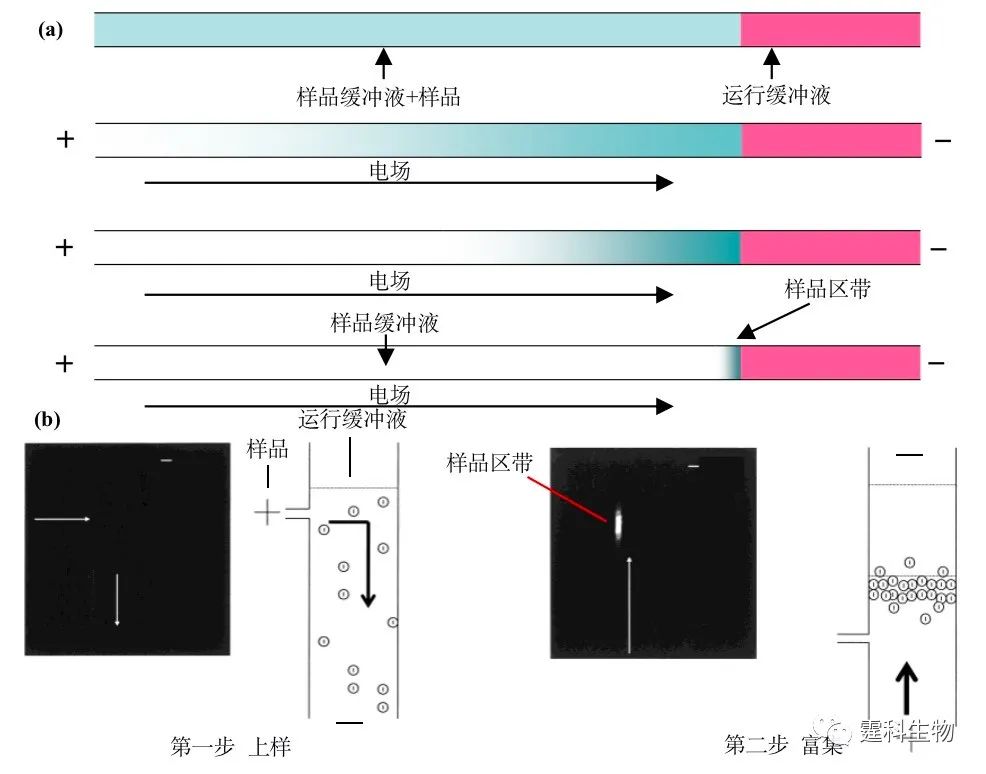
图5-26 等速电泳-电泳芯片及工作过程 5.8 场放大堆积 如果样品缓冲液的浓度远低于运行缓冲液的浓度且样品区带相对较长,在微通道两端加上电场,由于电场主要存在于样品区带两端,样品会以较快的速度运行至两种缓冲液的界面并在此堆积,产生一种富集效果,此即场放大堆积(field amplification stacking),见图5-27。
图5-27 场放大堆积 (a) 原理示意;(b) 一种场放大堆积芯片[36] (芯片设计,操作步骤和富集效果荧光显微照片) 场放大堆积的富集倍数决定于运行缓冲液与样品缓冲液的浓度比和样品缓冲液区带与运行缓冲液区带的长度比。这两个比例越高,富集倍数越大。 5.9 芯片实验室各种预处理手段一览 本篇涵盖了微流控芯片上最常用的几种样品预处理手段。这些手段的最终目的有二,提取复杂基质中的被分析物和富集样品中低浓度的被分析物。固相萃取和膜过滤都能同时实现复杂基质中样品的提取和富集。固相萃取能在各种材料的芯片上实现,能富集大小各异的分子,但操作较繁杂。膜过滤操作简单,但通常只能在PDMS等塑料芯片上实现,且只能富集大分子。多种预处理方法(表5-1)的提出为芯片实验室直接处理实际样品提供了有力的技术支撑,同时也丰富了芯片实验室概念的内涵和外延。 表5-1 各种芯片样品预处理手段一览 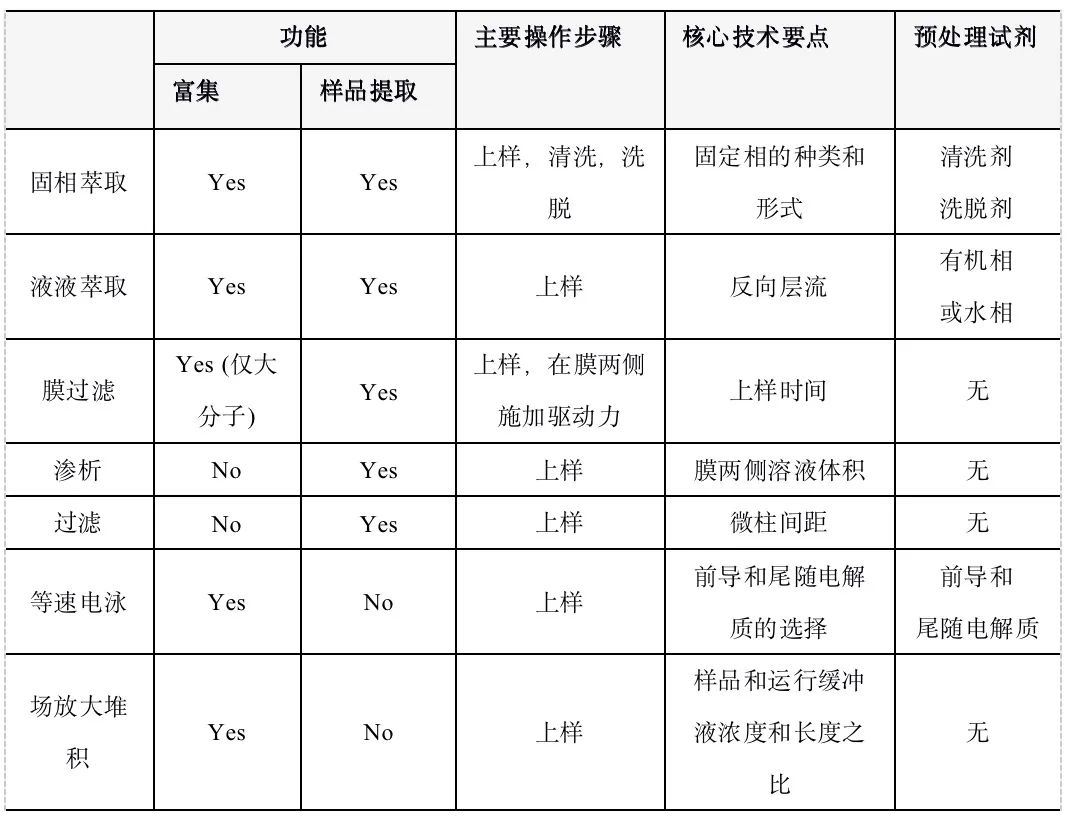 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |