|
|
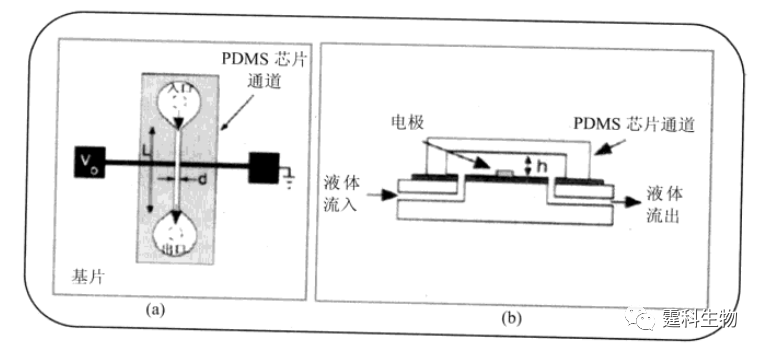
图解微流控|第42期发表时间:2022-05-04 21:40 微流控芯片实验室在 细胞研究中的应用(四) 13.3 微流控芯片在细胞研究中的应用 随着现代生物学研究模式的转化,以细胞为对象的微流控芯片研究已经引起诸多研究者的关注,其应用范围主要包括细胞状态、细胞功能和细胞组分研究三个方面。 13.3.1 细胞状态研究 细胞状态研究主要集中在细胞周期、细胞分化和细胞凋亡等方面。 13.3.1.1 细胞周期 细胞周期是指细胞从前一次分裂结束起到下一次分裂结束止的活动过程。细胞周期与多种人类疾病,特别是肿瘤的发生密切相关。正常或肿瘤细胞生长增殖时,细胞核内DNA结构及含量都会发生变化。因此,细胞核内DNA含量的测定能够反映正常的细胞周期变化及肿瘤细胞的恶性增殖。图13-34所示是一种基于微型芯片的“电容细胞仪”[62]。其原理是:当个体细胞由芯片通道入口流至出口,并经过频率为1 kHz的交变电场时,交流电容值发生变化,其变化程度与细胞内DNA含量成正比,可定量反映个体真核细胞内核DNA的极化反应,因此可用于细胞周期动力学研究。
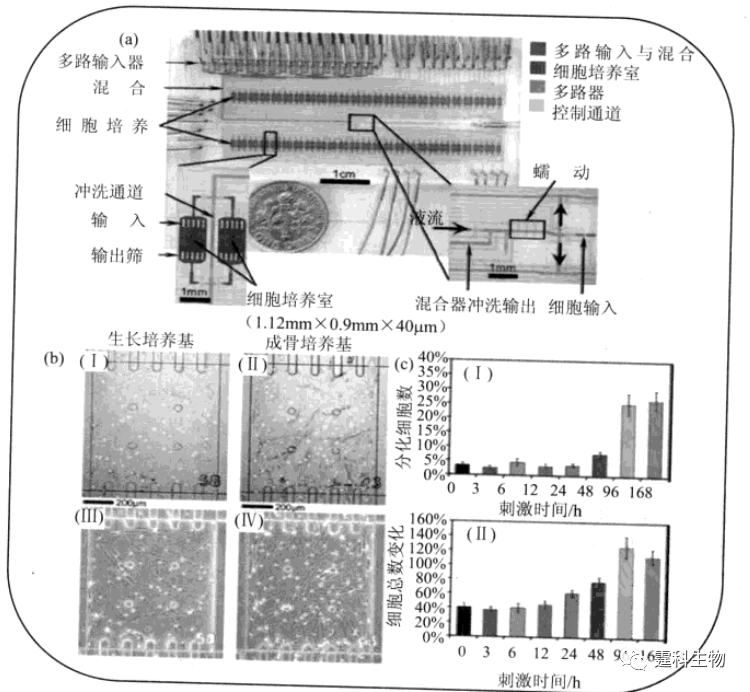
图13-34 微流控芯片“电容细胞仪”[62] (a) 芯片俯视图;(b) 芯片侧视图 芯片主要由细胞入口、出口、细胞通道和金电极组成,芯片通道长5 mm, 两个电极间距离30 μm 13.3.1.2 细胞分化 细胞分化是指在个体发育过程中通过细胞分裂在细胞之间产生稳定性差异的过程。图13-35所示是一种用于细胞分化研究的微流控芯片全自动细胞培养系统[63]。该系统包含96个细胞培养微室,每个微室内细胞接种密度,培养基成分和灌注时间都可通过集成在芯片上的一系列泵、阀进行控制。研究人员将芯片上培养的人骨髓间充质干细胞分为多组,对每组细胞分别设定培养基灌注种类和时间,并对干细胞在不同培养条件下分化为成骨细胞的情况进行观察。
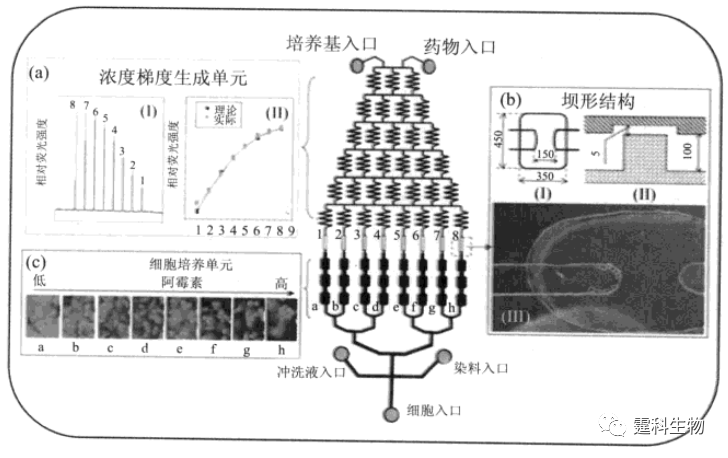
图13-35 微流控芯片全自动细胞培养系统[63] (a) 芯片各功能单元通道中灌入不同颜色染料以示区别;(b) 不同微培养室中细胞接受刺激后的光学显微镜明场(I,II) 和相差(III,IV)照片,(I,III):初始细胞数59,生长培养基作用168h后细胞数83;(II,IV):初始细胞数52,成骨培养基作用96h后细胞数160;(c) 成骨培养基作用时间对细胞分化(I)与增殖(II)的影响,细胞分化和增殖随培养基作用时间延长而明显增加 13.3.1.3 细胞凋亡 细胞凋亡是一种由基因调控的细胞主动死亡过程,在正常胚胎和器官发育、免疫反应、肿瘤和神经退行性病变等疾病发生过程中具有重要作用[64]。某些药物诱导肿瘤细胞发生凋亡是其作用机制之一。作者所在课题组建立了一套集成化微流控芯片系统,用于细胞凋亡研究[65]。如图13-36所示,该芯片利用微尺度下芯片通道内的层流混合、分流特征,并结合已有关于芯片浓度梯度生成器的研究工作[66],将多种药物浓度生成、芯片细胞培养、受激、标记及多种细胞响应检测等过程集成于一体,实现了对阿霉素(doxorubicin,DOX)诱导肝癌细胞(HepG2)凋亡过程的监测。同时,为避免向芯片灌注细胞悬液时细胞流入浓度梯度生成单元,在两功能单元之间设计了一排坝形结构(图13-36(b))并使之与上层盖片之间保留一微小缝隙,当流速较低时,此结构可有效阻挡细胞流入浓度梯度生成单元,同时又不影响药物溶液传递。
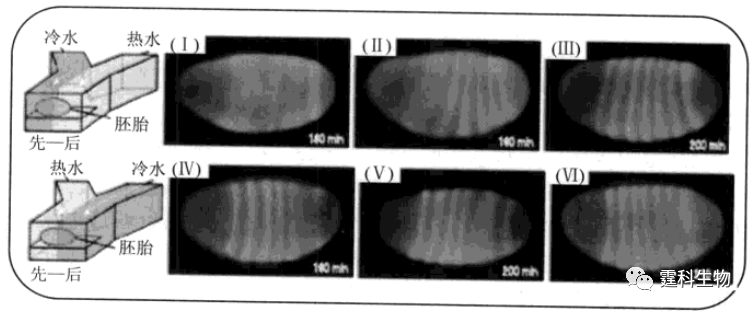
图13-36 集成化细胞凋亡研究微流控芯片[66] (a)两种浓度罗丹明-123溶液对浓度梯度生成单元考察的荧光检测结果(I)和浓度梯度曲线实测值与理论值相关性比较(II)(r=0.9995);(b)坝形结构的俯视图(I)和侧视图(II)以及细胞被坝形结构截流的光学照片(III)(×100),长度单位微米;(c)凋亡HepG2细胞线粒体膜电势的荧光检测结果,荧光探针Rh-123(×400) 13.3.2 细胞功能研究 细胞功能研究主要集中在细胞受激反应和离子通道等方面。 13.3.2.1 受激反应 受激反应是细胞对外界各种刺激所产生的响应,与多种重要生物学过程密切相关。微流控芯片的功能集成特征使其有利于实施外界条件对细胞(单细胞)的精确刺激,并检测细胞在此条件下的各种响应。如图13-37所示,Lucchetta[67]等将单个果蝇胚胎定位在Y-型PDMS芯片中央,通过微通道分别向胚胎两端施加不同水温刺激。结果发现,经不同时间和温度作用后,胚胎处于较热水温环境的部分发育速度相对较快,Hunchback基因表达(胚胎发育的标志性条纹出现)发生明显改变,且在特定时间段(65-100 min)内变化尤甚,但是经过一定时间(200 min)后,标志性条纹最终出现的位置和数量却没有改变。这说明生物体自身有一套补偿系统以应对周围环境变化所带来的影响。
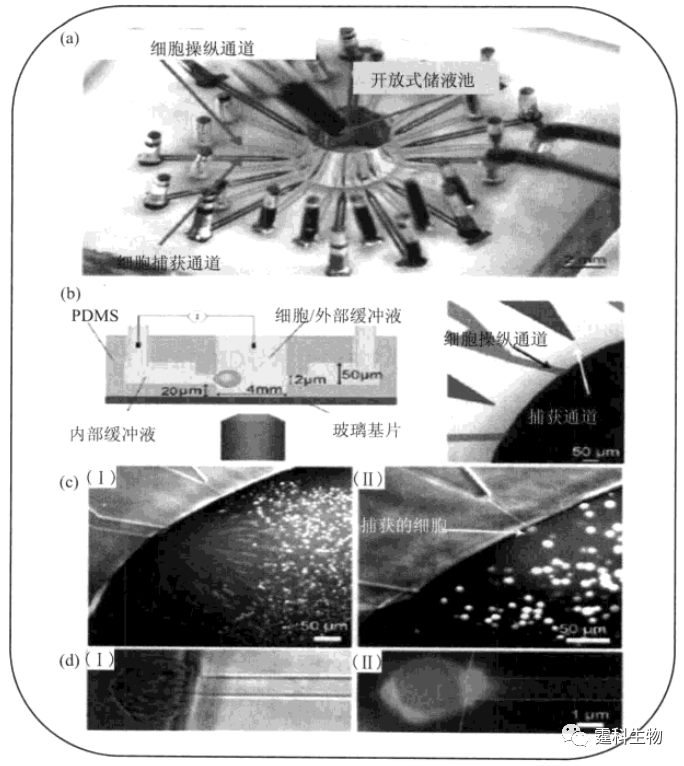
图13-37 温度梯度影响果蝇胚胎发育和基因表达[67] 温度梯度对果蝇胚胎基因表达的影响,其中(I-III)热水刺激早于冷水刺激,(IV-VI)冷水刺激早于热水刺激,Hunchback基因始终在受热水刺激那部分胚胎先表达,然而一段时间后,基因表达标志性条纹出现的数量和位置都正常 13.3.2.2 离子通道 离子通道是神经生物学研究的核心内容之一。离子通道的开放与关闭可调控细胞膜电位和细胞膜内外离子浓度,是神经元、肌细胞等可兴奋组织功能活动的基础。膜片钳技术是研究离子通道的传统方法,近年来已有研究者尝试将膜片钳和微流控芯片技术结合用于离子通道研究。图13-38所示是一种开放式PDMS微流控芯片膜片钳阵列[68],所有实验操作,包括单细胞捕获、细胞膜与膜片电极对接,细胞受激,K+ 电流检测,都可在芯片上完成。与传统方法相比,该法减少了微玻管电极(膜片电极或膜片吸管)的颤动,易于实现高阻封接,漏电流很小,且测得结果灵敏、可靠,并可实现通量分析。
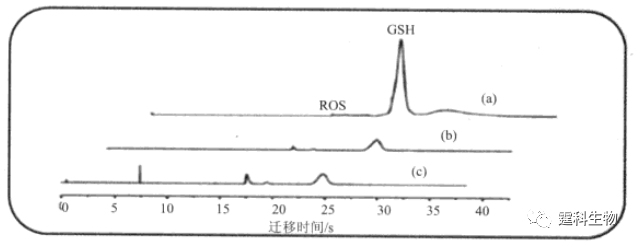
图13-38 开放式微流控芯片膜片钳阵列[68] (a) 芯片照片,浅色为细胞操纵通道,深色为细胞捕获通道,细胞和药物溶液由位于芯片中心的开放式储液池加入;(b) 细胞捕获通道横截面示意图;(c) 细胞被操纵(Ⅰ)和被捕获(Ⅱ)的光学显微镜照片;(d) 单细胞被捕获于通道入口处的明场照片(Ⅰ)和荧光照片(Ⅱ) 13.3.3 细胞组分研究 细胞内组分复杂,胞内特定组分或内涵物的分析测定对研究细胞代谢过程、细胞内信号转导、以及细胞功能具有重要意义。微流控芯片有可能将各种细胞操作技术集成为一体,是实现细胞内(特别是单细胞)组分分析的重要技术平台。 13.3.3.1 谷胱甘肽检测 还原型谷胱甘肽(GSH)和活性氧类(ROS)是细胞内重要信号分子,对维持细胞内氧化还原状态平衡起重要作用。作者所在课题组建立了同时检测细胞内ROS和GSH的微流控芯片-激光诱导荧光法,并以三氧化二砷诱导急性早幼粒白血病细胞(NB4)凋亡为模型,实现了对凋亡NB4细胞中氧化还原状态的监测[69](图13-39)。结果表明,低浓度氧化砷诱导NB4细胞发生凋亡,且出现细胞内氧化还原状态失衡,凋亡NB4细胞内GSH耗竭,ROS增多,这种改变呈现剂量效应。芯片电泳方法分析速度快、对两种物质的分离检测仅用27 s,克服了传统方法分析时间长,且难以对两种物质同时检测的局限性。
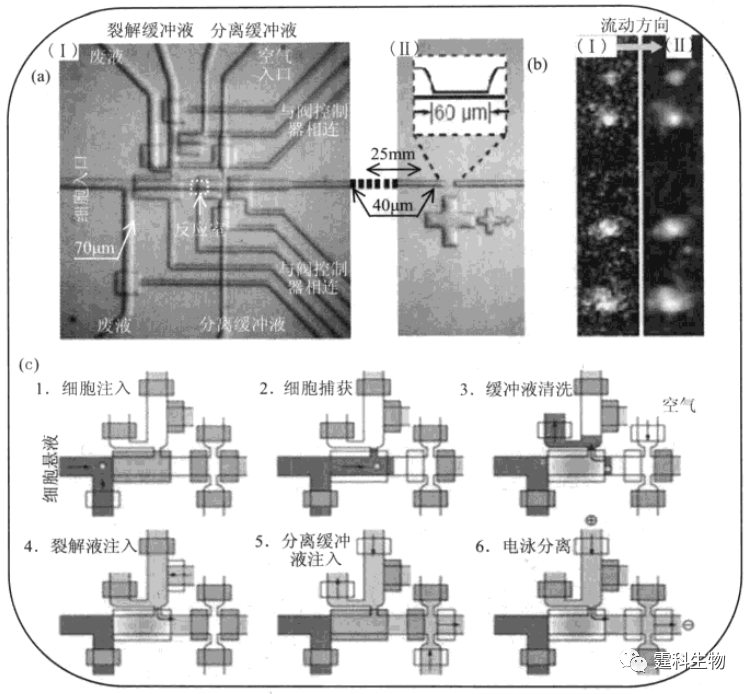
图13-39 微流控芯片-激光诱导荧光法检测细胞内ROS和GSH[69] 三氧化二砷作用72 h后,凋亡NB4细胞内GSH和ROS芯片电泳结果,随药物作用浓度升高,GSH显著降低而ROS略有升高 13.3.3.2 单细胞蛋白质检测 某些蛋白质在细胞中含量极低(小于1000个分子/细胞),但对于细胞功能的发挥却起着至关重要的作用,然而,现有分析方法难以在单细胞水上平对这类蛋白质进行检测。Zare研究组将微流控芯片技术与单分子荧光成像技术相结合,通过芯片上三相阀和双相阀的交替控制完成了单细胞捕获、裂解和胞内特定低拷贝数蛋白质标记、分离和检测[70](图13-40)。
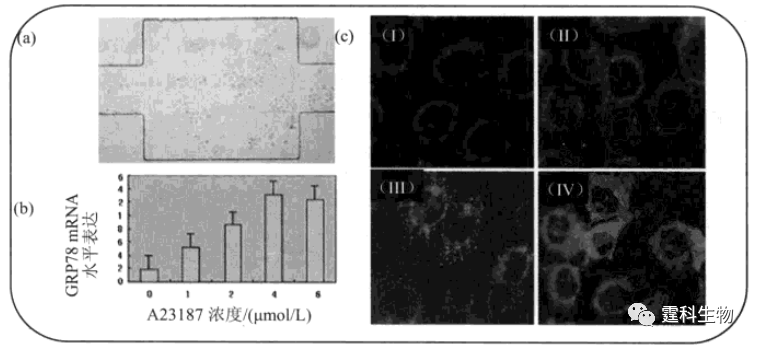
图13-40 微流控芯片单细胞蛋白质检测[70] (a)单细胞分析芯片设计图,(Ⅰ)为单细胞操纵部分,(Ⅱ)为单分子检测部分;(b)荧光分子CCD成像照片(Ⅰ)和单分子识别(Ⅱ);(c)单细胞操纵过程示意图 Wang[71]等人利用微流控芯片研究了糖调节蛋白78(Glucose-regulated protein 78,GRP78)在肺癌细胞(NCI-H460)中蛋白水平和mRNA水平表达。结果表明,A23187可诱导GRP78蛋白表达增强(图13-41)。
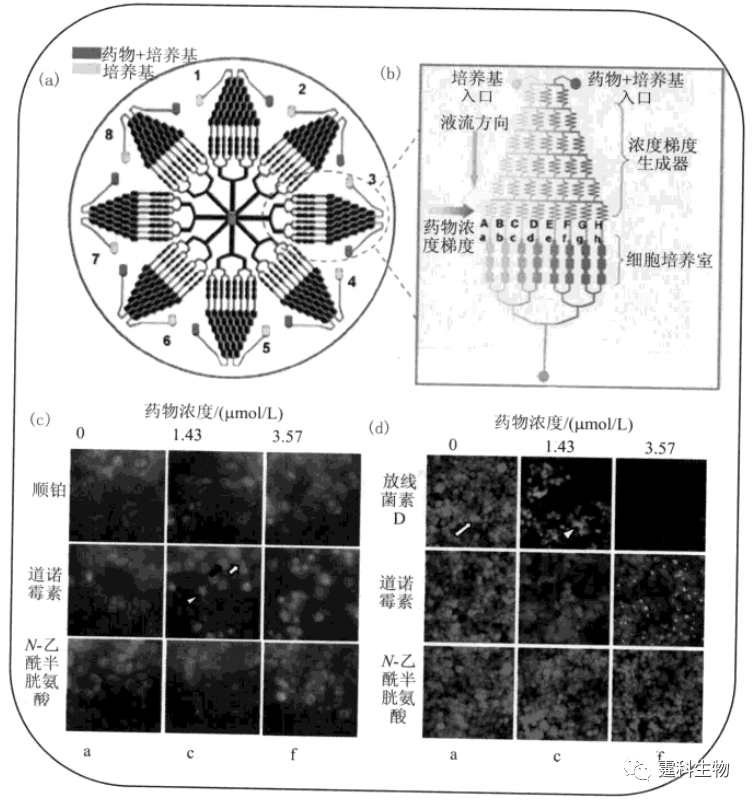
图13-41 微流控芯片肺癌细胞糖调节蛋白78表达研究[71] (a) 肺癌细胞在PDMS-玻璃芯片中生长;(b) A23187诱导GRP78在mRNA水平表达结果;(c) A23187诱导GRP78在蛋白水平表达结果,I-IV诱导剂浓度分别为0,1,2,4 μM 13.4 微流控芯片细胞研究应用示例 13.4.1 微流控芯片细胞水平药物筛选 药物筛选是新药开发的关键步骤,筛选模型通常可分为分子水平和细胞水平。细胞水平筛选因更接近于生理条件,准确率高,干扰因素少,已成为药物筛选的主流手段。高内涵筛选(high content screening,HCS)是细胞水平药物筛选的核心技术,它通过监测备选药物对细胞生长、分化、凋亡、代谢和信号转导等生理过程的影响,力求在单一实验中获得被筛样品对细胞产生的多维立体生物效应信息,以达到考察药物生物学活性及潜在毒性的目的[72]。 作者所在课题组以临床抗肿瘤药物诱导肝癌(HepG2)细胞凋亡为模型,构建了一种细胞水平高内涵药物筛选微流控芯片平台[73],将细胞培养、药物浓度梯度生成、细胞受激和响应等过程完全集成在一块只有几平方厘米大小的芯片上完成(图13-42)。一次运行可同时产生64种药物作用条件并可获得192个细胞响应结果。利用该芯片同时分析了药物作用后细胞线粒体膜电势变化、细胞核变化、细胞膜变化以及胞内氧化-还原状态变化。结果显示,不同药物诱导细胞凋亡呈现不同的剂量效应。该工作充分体现了微流控芯片将多种单元技术灵活组合和规模集成的特点,与传统的多孔板技术相比,省去了配制和分配多种药物不同浓度溶液的繁冗操作,大大简化了细胞接种、受激、洗涤和标记操作过程,显著降低了细胞和试剂耗量,具有重大应用前景。
图13-42 微流控芯片高内涵药物筛选[73] (a)芯片设计图,芯片由八个结构一致的单元构成,可同时实现八种药物,每种药物八个浓度作用一种细胞;(b)单一结构放大图,每个结构都包含一个药物浓度梯度生成器和细胞培养阵列;(c)不同药物作用后,线粒体膜电势(白箭头),细胞核(黑箭头)和细胞膜(白三角形)的变化;(d)不同药物作用后,细胞内还原型谷胱甘肽(白箭头)和活性氧(白三角形)的变化 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |