|
|
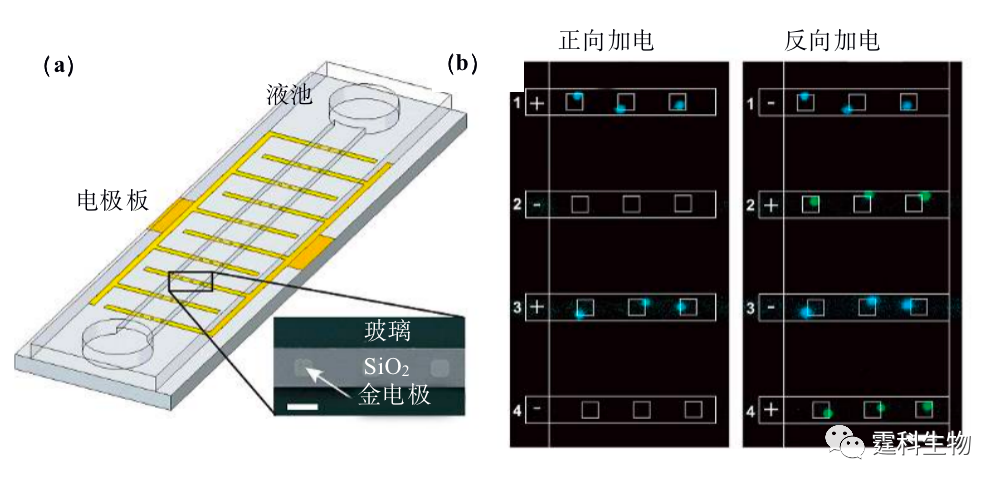
图解微流控|第41期Issuing time:2022-03-25 17:45 微流控芯片实验室在 细胞研究中的应用(三) 13.2.3 细胞捕获 在细胞分析中,往往需要将样品池中的细胞样品引入到微流控芯片通道中。借助电场力,介电力,静压力,磁场力等操纵手段实现对细胞的灵活操纵,并将细胞捕获在微流控芯片通道特定的位置。 13.2.3.1 电场力捕获细胞 细胞表面带有净电荷,在电场力作用下会发生运动,即电泳现象。高健等[39]通过反复切换一组低电压,使细胞在电场力作用下不断改变流速和方向,最终沉降至微通道底部并贴壁,这样可以控制细胞捕获在十字交叉口附近一定范围内,然后溶膜检测。Mathies等[40]利用如图13-22所示的芯片,使细胞在电场作用下向电极表面运动,同时与电极表面修饰的抗体发生免疫反应,分别在奇偶电极处施加不同方向电压,将两种细胞捕获在通道的不同位置。
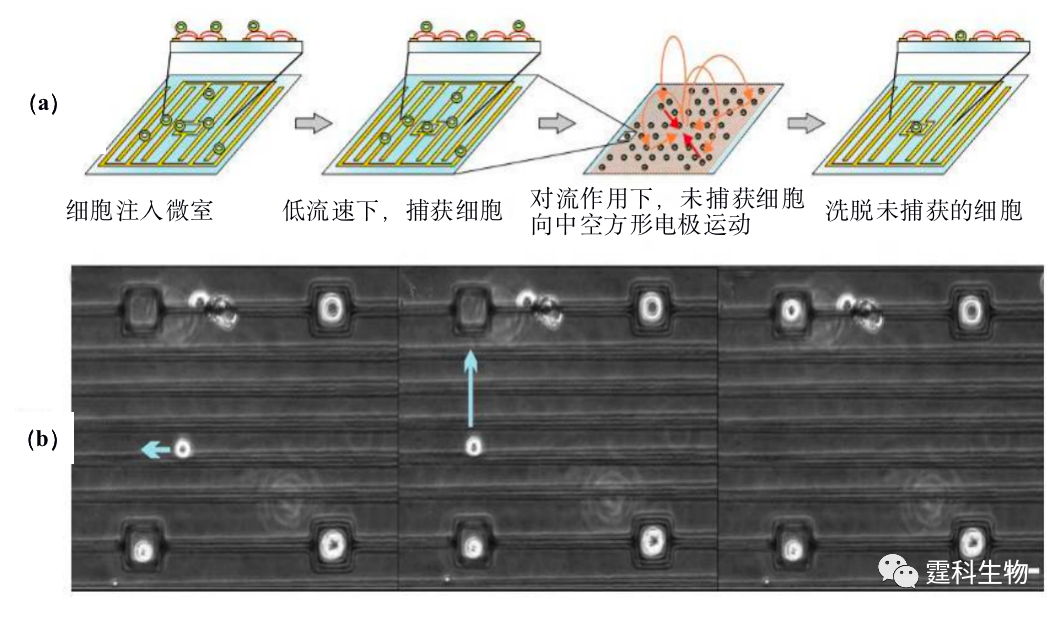
图13-22电场作用下顺序分离捕获两种CHO细胞[40] (a) 芯片结构示意图;(b) 正向电场50 V/cm作用10 min定位蓝色荧光标记硫醇化K1细胞;反向电场定位绿色荧光标记硫醇化K1细胞 13.2.3.2介电力捕获细胞 介电力除了可以用以细胞分选外,也可用于细胞的操控和捕获。Gray等[21]利用正向介电泳力将单个细胞捕获在直径为3 µm的微电极点阵上,当单个细胞被捕获在电极中间而占据了介电泳力最大的位置时,其余细胞由于介电泳力较小而被流动的溶液冲走。Mittal等[41]利用负向介电泳力作用来捕获单个细胞,他们设计如图13-23所示的平面微电极芯片,包含一中空方形电极和与之对应的线状电极,细胞在负向介电泳力作用下被推向电场最弱处,即方形电极的中空位置。由于该中空位置的大小和细胞相当,因此可以实现单细胞在特定位置的捕获。
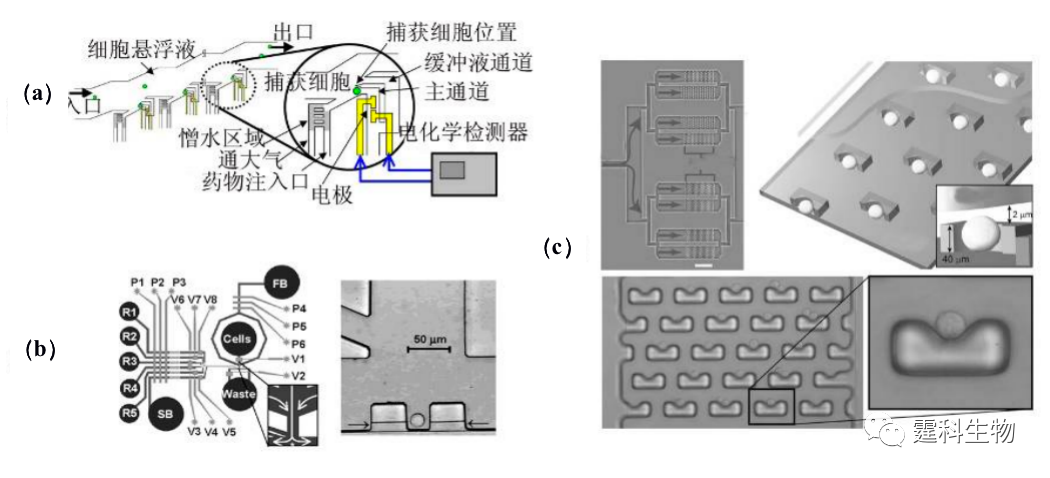
图13-23 负向介电泳捕获单细胞[41] (a)操作流程示意图;(b) 细胞捕获于中空方形电极 13.2.3.3流体动力学陷阱捕获细胞 与电场力相比,流体压力比较温和,对细胞活性的影响更小,因此更有利于操纵或捕获细胞。Yun等[42]设计了如图13-24(a)所示的芯片,细胞在压力作用下向前运动并被侧通道的液流带到捕获单细胞的位置。单个细胞被捕获在侧通道口,阻止主通道液流向该方向流动,则其余细胞会被主通道液流带至下一个细胞捕获口,从而形成阵列单细胞捕获。 Wheeler等[43]通过多层软刻蚀技术制作了如图13-24(b)所示的PDMS多层微流控芯片。一系列泵阀控制液体的流速和流向。低雷诺速的细胞悬液由T型通道顶部流向底部,向左右分成两股液流,在交点处出现静止点,通道底部设置超微型隔离室,单个细胞落入隔离室后,受隔离室体积限制其他细胞不能进入,据此可从细胞悬液中迅速隔离出单个细胞。Carlo等[44]设计了如图13-24(c)的微阵列芯片,采用半渗透微结构,单个细胞在微穴中定位后,其他细胞将改变流动方向,进入其他微穴,形成单细胞阵列。
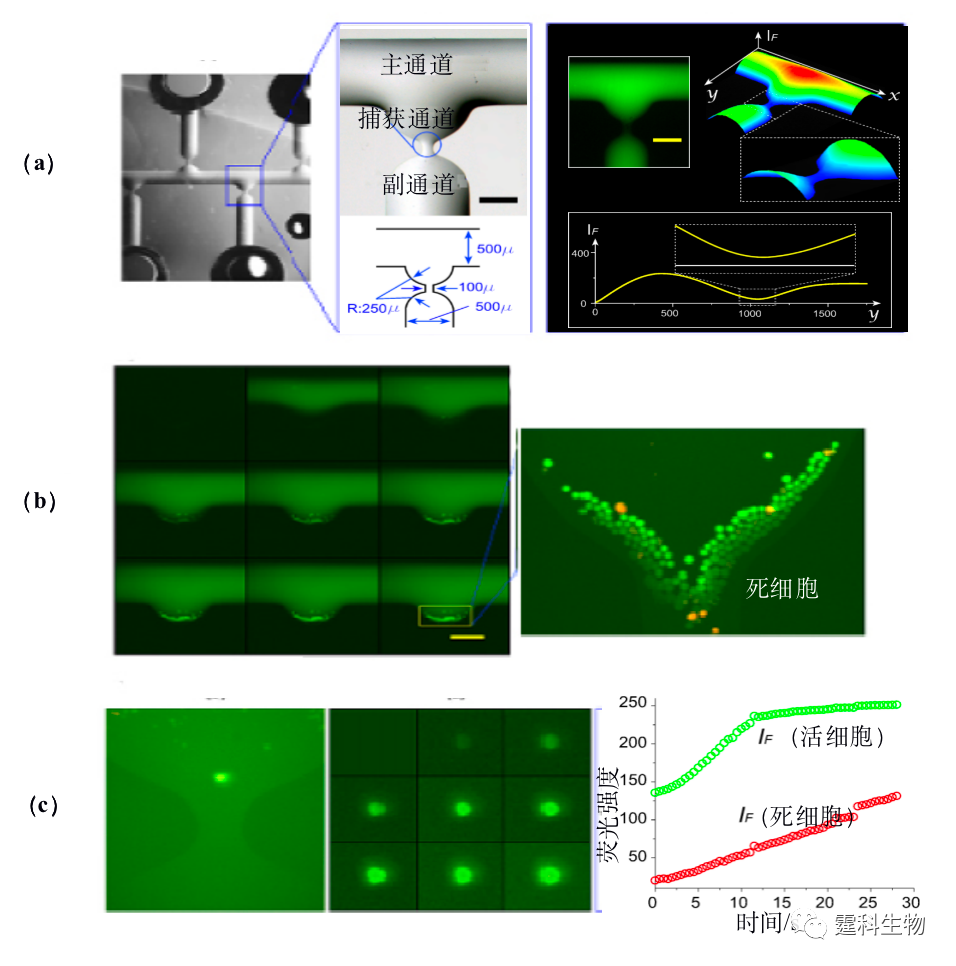
图13-24流体动力学陷阱捕获细胞[42-44] (a)捕获细胞芯片结构示意图;(b) 单细胞捕获细片示意图;(c) 微穴阵列捕获单细胞示意图 13.2.3.4空间位阻捕获细胞 利用传统的多层光刻技术,可制作出深、宽为数微米甚至纳米的各种“坝形”、“筛形”、“碗形”[45-48]微结构以阻挡细胞。但是制作这种结构的芯片需要复杂的光刻,多次曝光等工艺过程。作者所在课题组采用“液塑法”一次成型制作出多深度结构的芯片。图13-25所示是用该方法制作的细胞捕获芯片,其捕获单元为“T”型流路,总体通道宽度为500 μm,在“T”形交汇处有一段局部变窄的通道,其宽度和深度分别为50 μm和5 μm,此处即为芯片的细胞捕集区域。图13-25(a)为对通道结构定性考察结果,由沿支路方向的截面轮廓曲线可知,在捕集区,通道的高度由整体约50 μm,降至数微米,实现阻挡细胞流过的功能(见图13-25 (b))。当捕获通道的尺寸变窄,细胞悬液的浓度适当降低时,亦可实现单细胞的捕获,采用荧光实时成像技术可监测单细胞染色过程(图13-25 (c))。这种芯片有望用于细胞生理学过程动态实时观察。
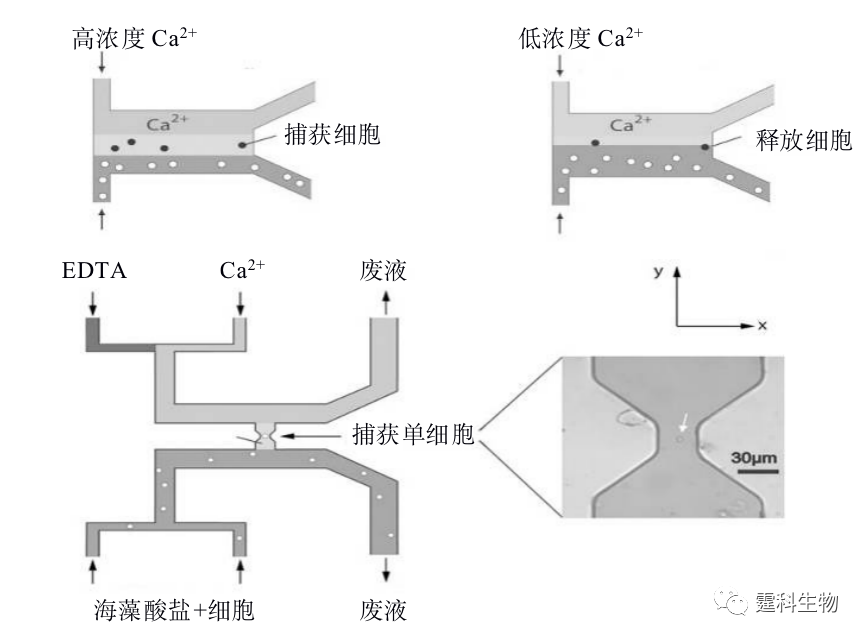
图13-25 细胞捕获芯片 (a) 芯片结构示意图和通道结构定性考察;(b) 细胞染色过程照片和细胞死活测定;(c) 单细胞捕获及染色 13.2.3.5固定化技术捕获细胞 固定化微生物技术是采用化学或物理的手段将游离细胞或酶定位于限定的空间区域内,该技术广泛应用于生物领域。载体材料多是天然蛋白和多糖,如:琼脂、琼脂糖、明胶、卡拉胶、黄原胶、阿拉伯胶、海藻酸钠等。Johann等[49]将这种固定化生物技术应用到芯片中,海藻酸钠在常温下遇见二价阳离子(如Ca2+、Ba2+等)时会发生离子移变,转变为既有强度又有弹性的水凝胶,该反应过程迅速,反应条件温和。通过改变Ca2+离子浓度即可迅速实现细胞捕获与释放,以及单个细胞特定位置的捕获(图13-26)。Maruyama[50] 等搭建了一套集激光与紫外的微流空芯片系统,将细胞与光敏感树脂ENTG-3800混合,用激光光镊来捕获目标细胞,定点紫外激发固化树脂,定位细胞,非目标细胞未被固定化随着液体流走,据此,可以从大量均质细胞中分离并研究异质细胞。
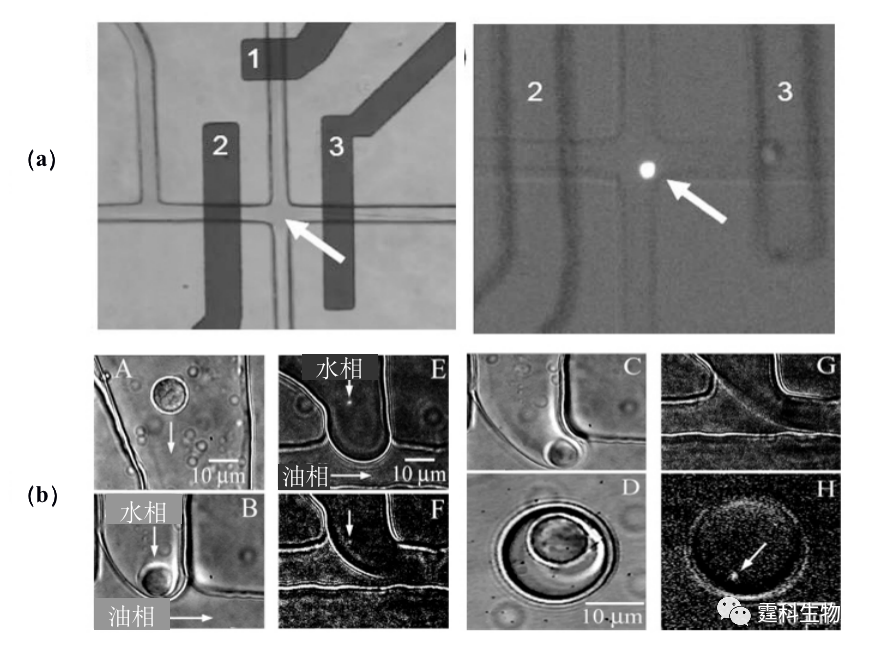
图13-26 海藻酸钠捕获细胞示意图[49] 另外,还可以通过PDMS泵阀[51],或液滴分离[52]等实现单细胞的分离和捕获(图13-27)。
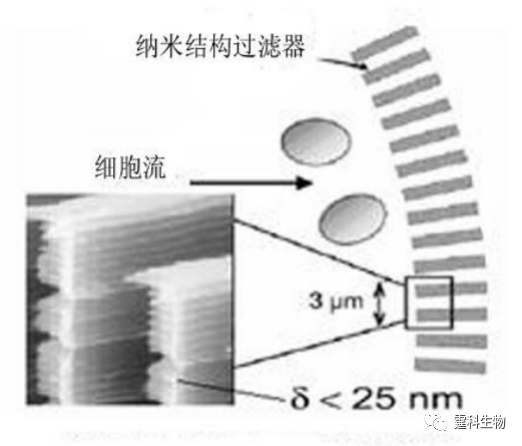
图13-27单细胞捕获[51-52] (a)泵阀捕获单细胞;(b) 液滴捕获细胞过程 13.2.4细胞裂解 细胞裂解是进行细胞内涵物电泳分离和检测的必要步骤。能否快速、有效地裂解细胞,是后续细胞内涵物检测的关键。目前,基于微流控芯片的细胞裂解方法主要有:机械裂解法、超声裂解法、热裂解法、化学试剂裂解法以及电裂解法等。 13.2.4.1 机械裂解法 随着微加工和刻蚀技术的提高,已可以在微流控芯片通道中刻蚀出纳米尺寸的坝形或刀形的微结构,用于机械捕获并破碎细胞。如图13-28所示[53],利用深度反应离子刻蚀技术(DRIE)在硅芯片通道内刻蚀纳米刀样精细结构,细胞在液压作用下,通过这些纳米刀结构时受到摩擦力的作用而破碎。
图13-28 纳米刀裂解细胞示意图[53] 13.2.4.2超声裂解法 细胞在持续超声波作用下可以发生快速裂解,图13-29是微超声波仪,炭疽病毒被输入与超声波连接的腔体,30 s后裂解[54]。Talyor等[55]将超声仪整合到微流控芯片上,改进了超声波发生器尖端和液体的接口,保证超声波的能量能连续、完全地传递到液体中,实现了细胞孢子的在线快速裂解,以及胞内DNA的PCR扩增和检测。
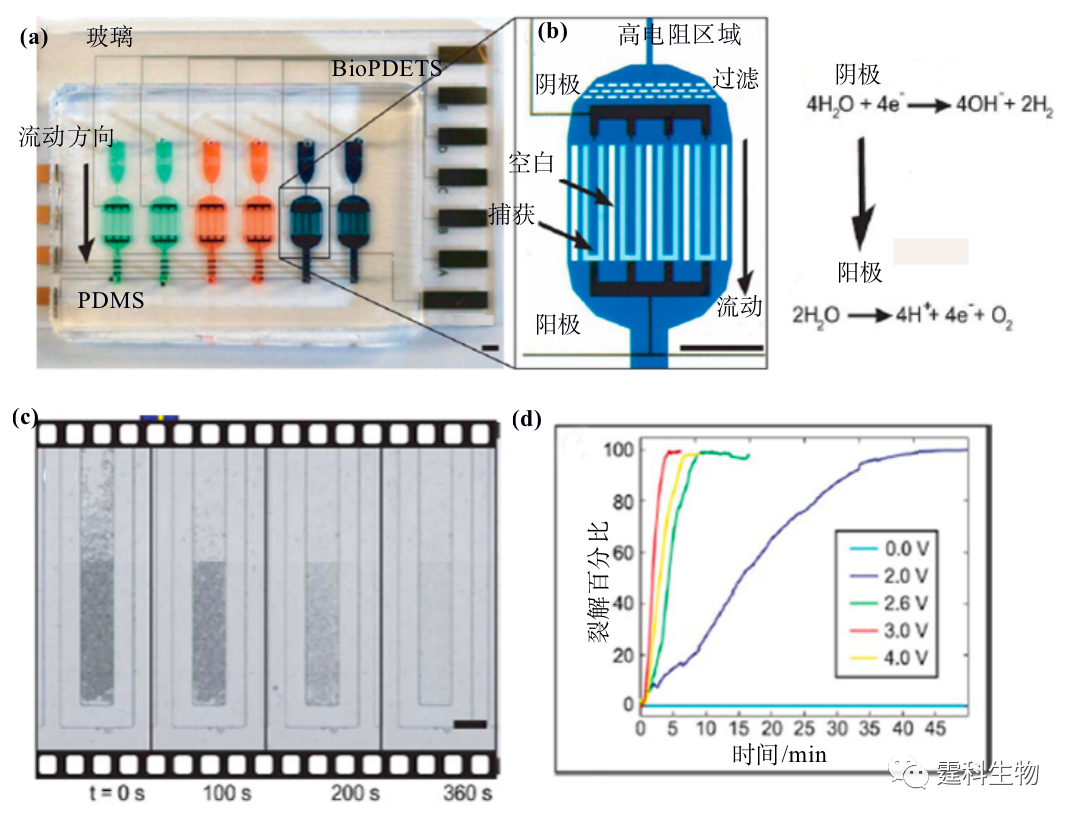
图13-29 微超声仪[54] 13.2.4.3热裂解法 利用芯片PCR的控温装置,可以实现细胞的热裂解。Waters等[56]在PCR区域控温94℃,4 min实现大肠杆菌热裂解,并完成核酸的PCR扩增、电泳分离。Liu等[57]在集成了泵阀、加热器和DNA传感器的芯片上了实现了血液中病原性细菌热裂解PCR反应和DNA杂交等过程。热裂解的缺点是裂解时间较长。 13.2.4.4化学试剂裂解法 相对而言,化学试剂是生物实验中最为常用的裂解方法,该方法具有简单、有效、不需附加设备和易于实现等特点。常用的化学试剂主要有十二烷基磺酸钠(SDS),毛地黄皂苷,强碱NaOH等。图13-30是一块集成了细胞培养和细胞裂解的PDMS芯片,该芯片可实现连续多天细胞培养,同时在芯片上通过电解质水解的方法产生高浓度的OH-,使细胞快速裂解[58]。
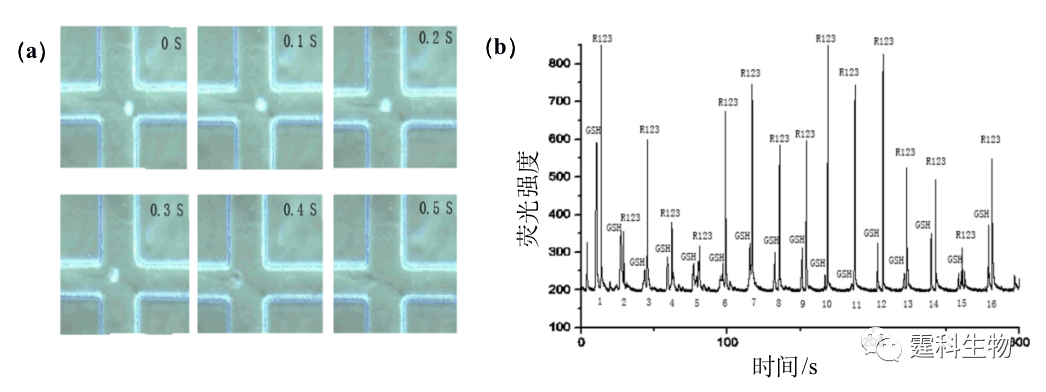
图13-30 集成细胞培养和细胞裂解的PDMS芯片[58] (a) PDMS芯片结构示意图;(b) 芯片微室结构和电解质水解原理;(c) 细胞裂解实时CCD图像;(d) 在不同电压下细胞的裂解百分比 作者所在的实验室发现微通道表面经过涂层修饰后电渗被完全抑制情况时,细胞在化学试剂作用下裂解的速度会大大提高;课题组由此建立了一种基于PDMS芯片的简单、快速、高通量的单细胞内小分子和核酸的分析方法。图13-31为细胞在0.2% SDS作用下裂解的实时图像,以及测定单细胞内谷胱甘肽、罗丹明123的电泳谱图。
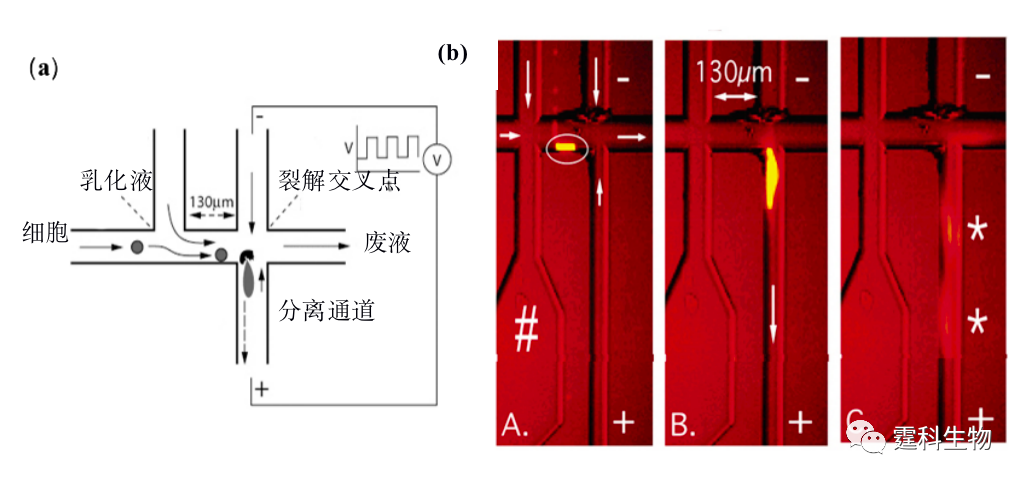
图13-31单细胞裂解及内涵物检测 (a) 细胞裂解实时图像;(b) 连续检测单细胞内罗丹明123和谷胱甘肽电泳谱图 13.2.4.5电裂解法 细胞在脉冲电场的诱导下会产生跨膜电势,当这种电势高于1V 时,细胞膜的通透性增加,可以与外界发生物质交换,通常利用这种特性可将外源DNA、RNA、蛋白质或各种染料导入细胞内,当脉冲电场消失后细胞膜恢复到原样,这种现象称为电穿孔。值得注意的是,当细胞处于持续高频的脉冲电场作用时,细胞膜就会完全破碎。图13-32[59]是细胞在高压直流电叠加一个高频方波脉冲电场的作用下,被快速(<33 ms)裂解的图像。
图13-32 脉冲电场快速裂解细胞[59] (a) 芯片结构示意图;(b) 电裂解细胞实时荧光图像 前面提及的介电电泳不仅用于捕获细胞和分选细胞,亦可用于裂解细胞。Lu等[60]设计了一种带有立体锯齿状电极阵列的微流控芯片,利用相对低频的电场产生的电穿孔效应来诱导细胞膜穿孔乃至破裂。Ramadan等[61]在一块如图13-33所示平面城垛形电极阵列的介电泳芯片上,将连续电穿孔细胞裂解、微珠上DNA键合和微珠介电泳分离等步骤集成在一起,为实现芯片上完全自动化细胞内DNA分析提供可能。
图13-33介电电泳捕获和裂解单个白细胞图像[61] (a) 未加电之前;(b) 加电后细胞受正向介电力作用捕获在电极表面;(c) 白细胞裂解残骸实图 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |