|
|
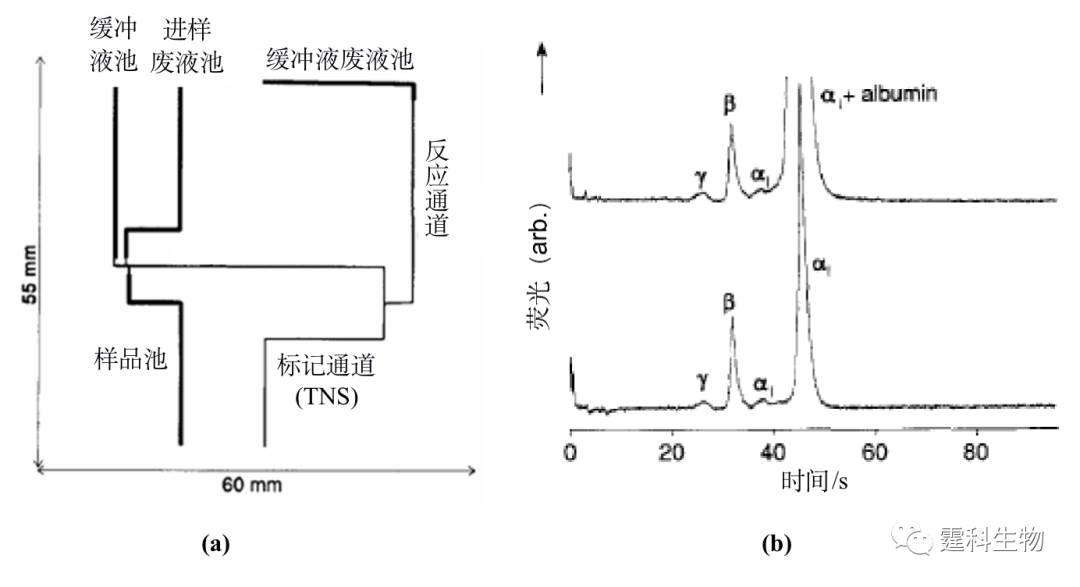
图解微流控|第34期发表时间:2022-02-18 16:26 微流控芯片实验室在蛋白质研究中的应用(二) 11.1.2 蛋白质的分离 蛋白质组研究的基本任务之一是进行蛋白质混合样品的分离,电泳和色谱是两种主要的蛋白质分离技术。各种毛细管电泳和色谱的分离模式都已经在微流控芯片上成功用于蛋白质的分离。随着蛋白质组学研究的深入,芯片上的二维分离能力逐渐被人们所认识,它在提高分离度、增加峰容量上的优势使其成为目前重要的研究方向之一。在本书的第七章,已从分离技术的角度对这一问题作了阐述,本章则着重强调分离对象是蛋白质时的特殊性。 11.1.2.1 芯片电泳 芯片电泳不仅具有较高的分离效率,还可与其它功能单元相结合,实现进样、分离、检测等多步骤的集成化,因此更为人们所关注。理论上,芯片上的蛋白质分离可以采用毛细管电泳中所有的分离模式,而蛋白质所特有的性质决定了其在实际分离中大多采用筛分电泳和等电聚焦。 ① 芯片区带电泳分离 众所周知,芯片区带电泳是在微通道中直接利用物质的质/荷比差异实现分离的一种电泳模式。由于其所用的分离介质简单,分析速度快,因此成为最早用于蛋白质分析的芯片电泳分离模式。Harrison研究组[17]在一块玻璃石英杂交微流控芯片(见图11-15(a))上,以100 mM硼砂加2 mM乳酸盐(pH 10.5)作为缓冲液,区带电泳分离了人血清蛋白模型体系(见图11-15(b))。但由于使用的磺酸盐类染料(TNS)标记血清蛋白质的灵敏度较低,只分辨出四个区带,还没有实现真实人类血清样品内的所有的五个蛋白质区带的分离。对蛋白质而言,芯片区带电泳分离模式一般存在较为严重的管壁吸附,因此影响分离效果,目前已较少采用。
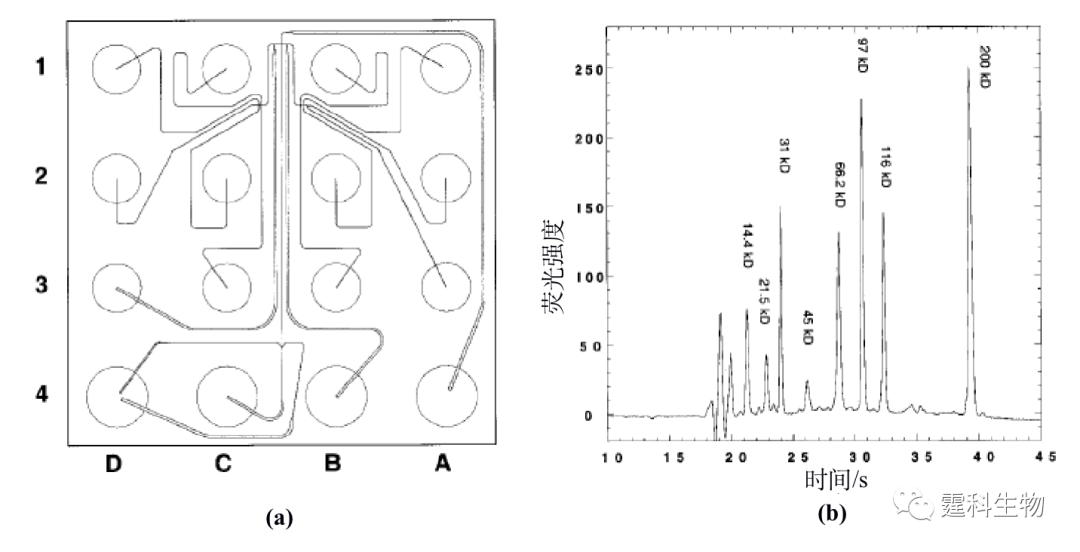
图11-15 人血清蛋分析用微流控芯片[17] (a) 芯片示意图;(b)人血清蛋白芯片自由溶液电泳图 图(b)中,IgG模拟r带,转铁蛋白模拟β带,a-1-胰蛋白酶抗体模拟a1区带,外加白蛋白(albumin)区带 ② 芯片筛分电泳分离 筛分电泳是传统的平板电泳和毛细管电泳中研究最多、应用最广的一种电泳分离模式,它是利用生物大分子和筛分介质(高分子溶胶或凝胶)之间的动态交缠作用,把被分离物质按照分子量大小分开的一种技术。最初的微流控芯片凝胶筛分电泳采用将凝胶颗粒填充在微流控芯片的通道内[18]来完成,通过对毛细管和玻璃微流控芯片通道中的凝胶筛分电泳分离性能比较后,发现微流控芯片不论是在柱效还是在分离速度方面都比石英毛细管优越。主要的问题是凝胶柱制备困难,寿命短。无胶筛分电泳作为凝胶筛分电泳的一种替代技术,在实际中应用更为广泛。Agilent公司利用无胶筛分电泳分离模式,设计出第一台根据分子量大小分离蛋白质并进行定性和定量的仪器(Agilent 2100 蛋白质分析仪)[8]。在如图11-16(a)所示的只有几平方厘米的玻璃微流控芯片上,将筛分剂装入、试样的制备、标记、分离和激光诱导荧光检测等步骤集成在一起,45 s之内分离了分子量从14.4 kD到200 kD的8种蛋白质(如图11-16(b)所示),比传统的平板凝胶电泳方法快近四个数量级。
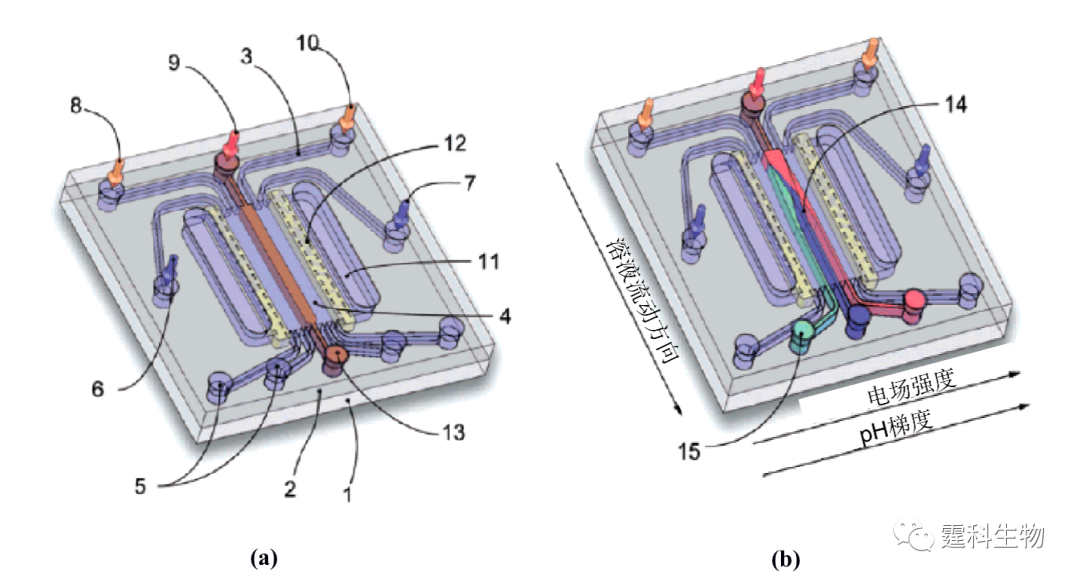
图11-16 Agilent 2100 蛋白质分析微流控芯片[8] (a) 芯片示意图;(b) 蛋白分子量标准样品无胶筛分电泳图 图(a)中,一块芯片上包括四个平时处理的通道,可以同时处理4个不同的样品,D4是SDS稀释液缓冲池,A4和C4是分离缓冲液池和废液池,B4和D3是清洗液池,其余的则为样品池 ③ 芯片等电聚焦分离 蛋白质是一种两性电解质,其荷电的状况视介质的pH而异。前已述及,在某一个pH时,蛋白质分子的表观电荷数为零,通常将使某一个蛋白质表观电荷数为0的pH值称为这一蛋白质的等电点(pI),不同的蛋白质等电点不同。如果两性电解质分子处于pH与pI一致的介质中而介质又不受电渗的推动,则该组分的定向迁移就会停止。如果介质中的pH是位置的函数,那么有可能使有不同pI的两性电解质分子聚集在不同的位置上,不作迁移而实现分离,这就是所谓的等电聚焦过程。在微流控芯片上实现等电聚焦,不仅可以减少样品的消耗,而且可以充分利用微流控芯片通道内试液处于层流状态并易于控制等特点,实现自由流等电聚焦分离蛋白质,在图11-17中[19],所形成的pH梯度和缓冲液的流动方向垂直,因此可以实现大量蛋白质样品的分离。在外加电场的作用下,不同的蛋白质组分一边进行电泳迁移,一边实现聚焦的过程,在2 s内就完成了7种不同等电点蛋白质(pI值分别为4.0,5.1,6.2,7.2,8.1,9.0,10.3)的分离。
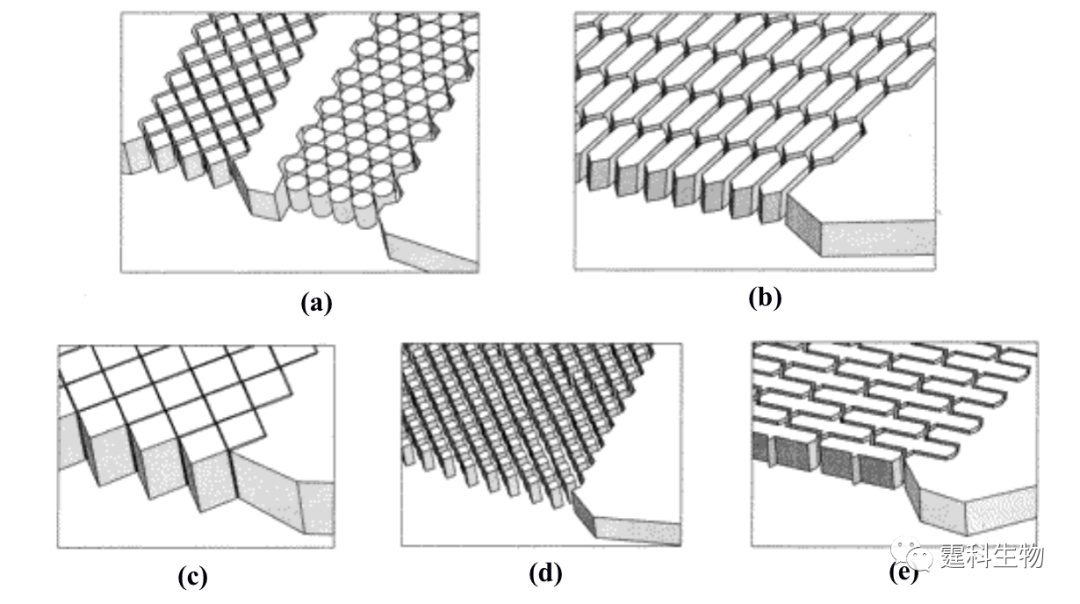
图11-17 自由溶液等电聚焦外观图以及工作原理[19] 图(a)未施加电压;图(b)施加电压并实现三个蛋白质的等电聚焦 图中1.芯片下层;2.芯片上层;3.微流控通道;4.分离室;5.出口;6.低pH液流进入通道;7.高pH液流进入通道;8-10.分别为两性电解质的进入通道;11.电极;12.导电薄膜;13.未聚焦的样品通道;14.聚焦的样品通道;15.收集的样品 11.1.2.2 芯片色谱 由于需要在微流控芯片的通道内填充色谱分离介质,因此有一段很长的时间,芯片色谱的发展远不如芯片电泳。后来发现,采用MEMS技术可以较方便地在芯片通道内制备出分离性能良好的色谱柱,因此,芯片色谱技术也在蛋白质的分离分析中得到了一定的发展。如图11-18所示,在石英微流控芯片上利用MEMS技术可以加工出有序排列整体载体结构[20],该载体表面经C18 修饰后用于色谱分离卵白蛋白的胰蛋白酶解产物与梯度洗脱的常规C18 HPLC分离相比,峰容量相当而分析速度却快了很多。
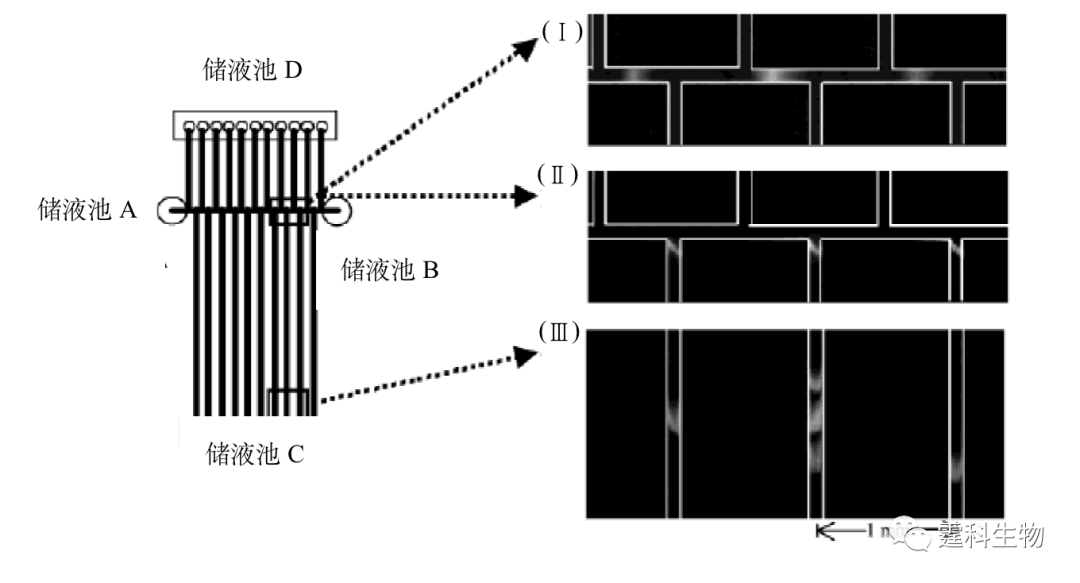
图11-18 各种不同几何构型的有序排列整体载体结构示意图[20] 载体结构的形状分别为:(a)圆柱形和立方形;(b)六方形;(c)金刚石形;(d)金刚石形;(e)长方形 11.1.2.3 芯片二维分离 蛋白质组学的研究需要对大量的蛋白质进行分离,采用传统的一维分离方法显然不能满足要求,二维分离技术是实现蛋白质高效分离的核心平台。平板上等电聚焦电泳和凝胶电泳结合的二维电泳是蛋白质分析的传统方法,在蛋白质或者蛋白质组研究中做出了很大的贡献。但是这类方法操作繁琐、耗时耗材等缺点,限制了蛋白质或者蛋白质组学研究的发展。微流控芯片设计任意、运行快速、耗样量少又不存接口问题,在蛋白质组多维研究中显示了很大的潜力,已有多个研究小组在该方面进行了有益的尝试,并得到了较好的结果。Li等[21]设计了一块多通道的聚碳酸酯芯片,如图11-19所示,在横向的通道内先进行第一维等电聚焦分离,然后通过电压驱动将聚焦后的区带送入垂直的通道内进行第二维凝胶电泳的分离,其中第二维的凝胶介质可以有效防止第一维的分离介质进入第二维的通道,而电压驱动则可大大减少转移过程中出现的样品损失,10 min之内5个标准蛋白质得到完全分离,峰容量达1700。其他二维电泳虽然通道构型不一,但基本设计思路与之类似。
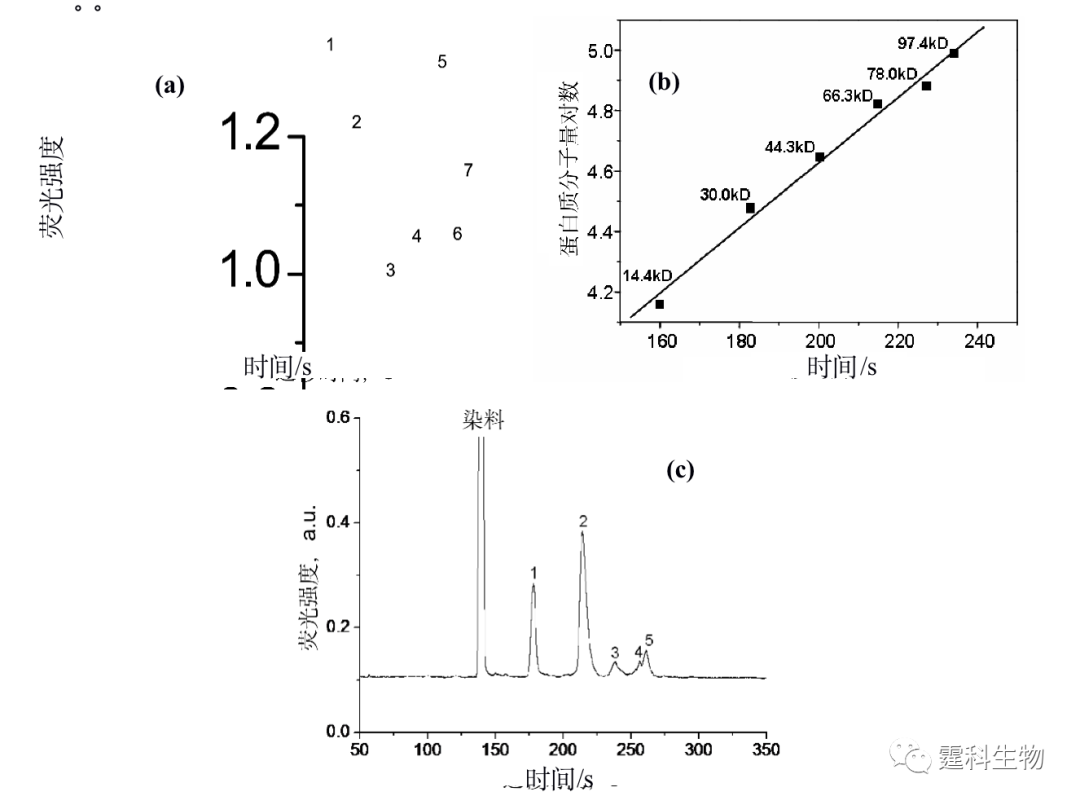
图11-19 等电聚焦/SDS-凝胶电压二维芯片示意图及标准蛋白分离结果[21] 放大部分:(Ⅰ) 90 s后第一维等电聚焦分离结果;(Ⅱ)将一维分离后的蛋白质经电动转移进入二维通道;(Ⅲ) 150 s后第二维SDS-凝胶电泳分离结果 11.2 微流控芯片在蛋白质分析中的应用 和核酸相比,微流控芯片在蛋白质领域的应用显然稍逊一筹,这是因为,迄今为止,高分辨率高峰容量的二维芯片电泳虽有发展但尚未真正成功,而芯片电泳和质谱联用的接口尽管在技术上已没有大的障碍,但大规模的应用仅刚刚开始。尽管如此,还是有很多研究小组在蛋白质应用领域做出了很大努力。 11.2.1 蛋白质的性质鉴定 蛋白质的性质鉴定主要包括对蛋白质分子量和等电点等理化性质的确定。传统用于蛋白质分子量测定的方法一般采用聚丙烯酰胺凝胶电泳,但是该方法整个操作过程繁琐费力,采用微流控芯片凝胶筛分电泳可以实现快速、高效、高灵敏度的测定。作者所在实验室[22]以自制玻璃十字架微流控芯片为平台,采用无胶筛分电泳分离模式对蛋白质分子量标准样品(内含六种蛋白质)进行了分离(见图11-20(a)),以此建立了分子量对数-迁移时间曲线(见图11-20(b)),将免疫球蛋白G不同片段进行芯片无胶筛分电泳分离谱图(见图11-20(c))所对应的迁移时间与该分子量对数-迁移时间曲线进行对照,可以得到免疫球蛋白不同片段的分子量。
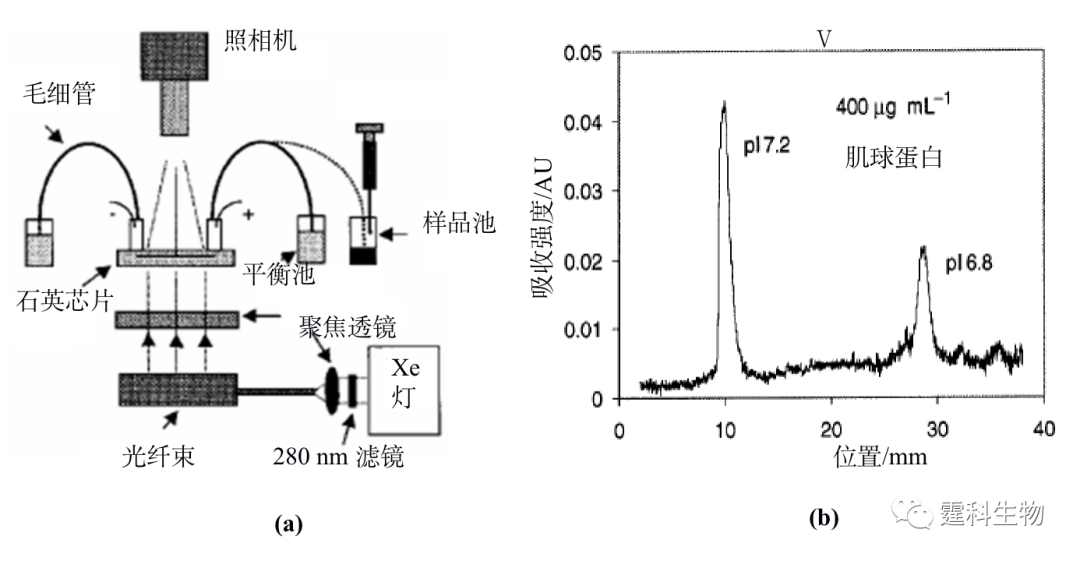
图11-20 微流控芯片无胶筛分电泳用于蛋白质分子量的测定[22] (a) 蛋白质分子量标准样品的微流控芯片无胶筛分电泳谱图;(b) 蛋白质分子量的对数与其迁移时间的线性关系曲线(回归系数为0.994) ;(c)抗体免疫球蛋白G片段的微流控芯片无胶筛分电泳谱图 图(a)中所对应的峰:1.染料;2.溶菌酶;3.碳酸苷酶;4.卵白蛋白;5.人血清白蛋白;6.伴清蛋白;7.磷酸化酶B。图(c)中1-5为免疫球蛋白G对应的不同片断 前已述及,当蛋白质处于pH与pI一致的介质中时,迁移就会停止,那么不同pI的蛋白质分子可以聚集在不同的位置,由此根据位置可以确定未知蛋白质的等电点。Mao等[23]利用一套表面涂层的石英芯片和CCD吸收成像全程检测装置(见图11-21(a)),用等电聚焦法分离肌球蛋白,结果发现所测的肌球蛋白样品是两种带不同等电点蛋白质的混合物(见图11-21(b))。
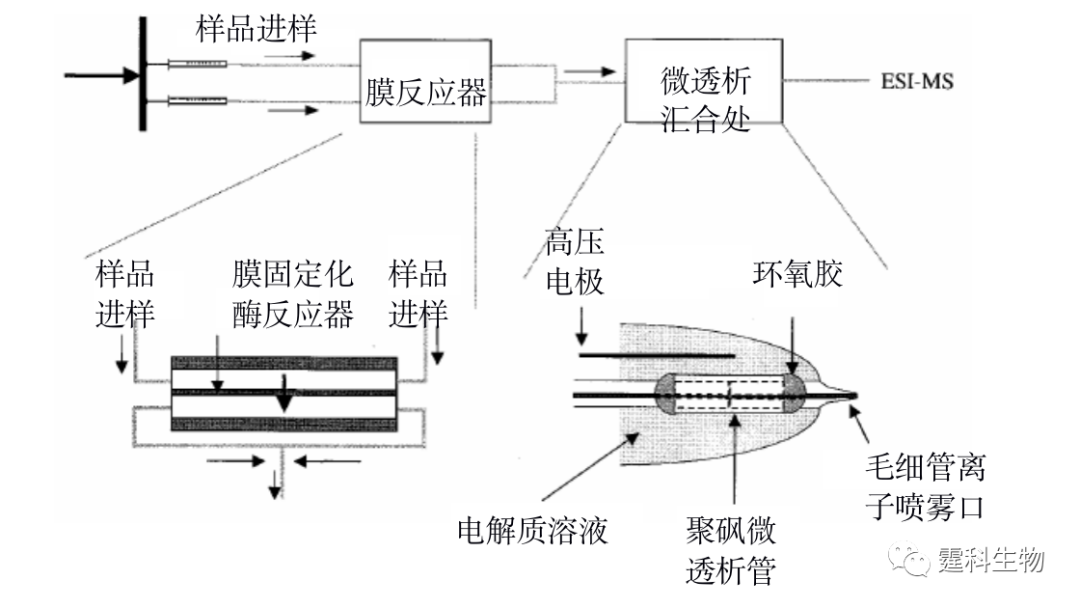
图11-21 微流控芯片等电聚焦用于蛋白质等电点的测定[23] (a) 芯片和全柱检测系统示意图;(b) 等电点为7.2和6.6的肌球蛋白等电聚焦分离电泳图 11.2.2 蛋白质的结构分析 11.2.2.1 蛋白质的氨基酸序列 蛋白质的一级结构是蛋白质多肽链中氨基酸残基的排列顺序,也是蛋白质最基本的结构。蛋白质氨基酸序列分析的一般过程是:蛋白质先经过蛋白酶水解得到肽,然后用质谱测定肽的分子量得到肽谱,再进行数据库搜索得到蛋白质的氨基酸序列。微流控芯片上较易实现的各种操作,如蛋白质进样、脱盐、酶解、富集和分离等,易与高效率、高灵敏度的质谱检测器联用,使得蛋白质的氨基酸序列分析更加快速、简便和准确。图11-22显示[11],将胰蛋白酶反应器和芯片电泳集成在微流控芯片上并与质谱联用,3~6 min内就可完成蛋白酶水解反应,对细胞色素C和牛血清白蛋白的氨基酸序列覆盖率分别达到了92%和71%。
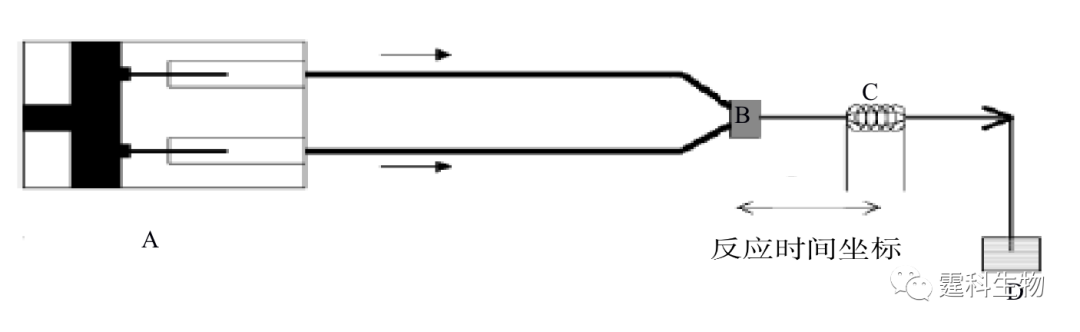
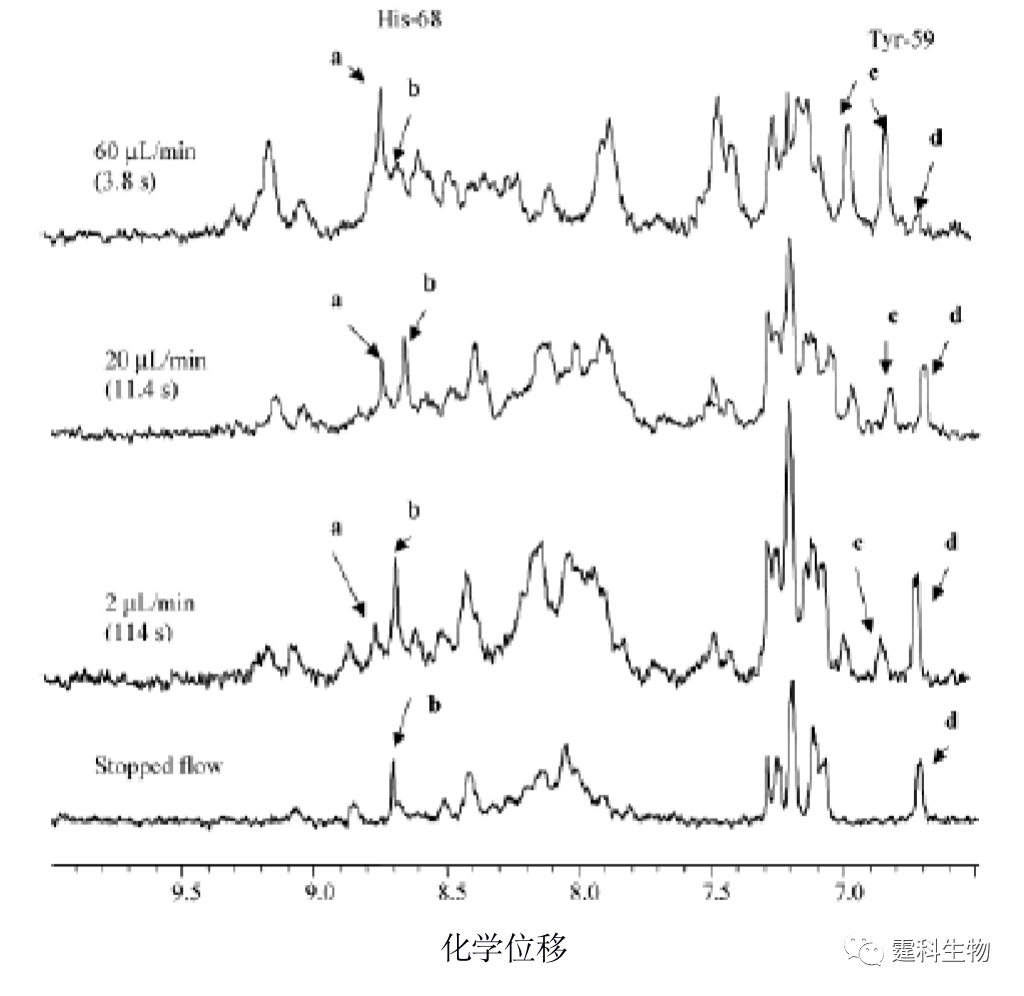
图11-22 集成有膜酶切反应器的微流控芯片和质谱联用系统用于测定蛋白质的氨基酸序列[11] 11.2.2.2 蛋白质的构象 一个有活性的蛋白质分子不但有特定的氨基酸序列,还具有一定的空间构象。特定的空间构象主要由蛋白质分子中肽链和侧链R基团形成的次级键维持。在生物体内,蛋白质的多肽链一旦被合成,即可根据一级结构的特点自然折叠和盘曲,形成一定的空间构象。蛋白质的空间构象是其功能活性的基础,构象发生变化,其功能活性也随之改变。因此蛋白质构象的确定对蛋白质功能的研究具有重要的意义。 Manz研究组[24]把微混合器和核磁共振(NMR)探针集成在微流控芯片上,制作了一个基于时间分辨核磁共振的蛋白质构象变化研究装置(图11-23)。在该装置上,化学变性剂和蛋白质溶液分别通过两根毛细管进入微混合器中进行充分快速混合,并且通过调节混合点到检测点的距离和液体流速来控制化学变性剂与蛋白质相互作用的时间,在低pH值和40%或更高的甲醇/水混合溶剂中,通过观察泛素中His-68和Tyr-59的质子核磁共振图,可以确定蛋白质的构象变化,见图11-24。该方法既可降低试剂的消耗,又可满足核磁共振检测的最低要求。
图11-23 集成有时间分辨核磁共振的芯片系统示意图[24] A. 蠕动泵;B. 混合器 ;C. NMR检测微池;D. 废液池
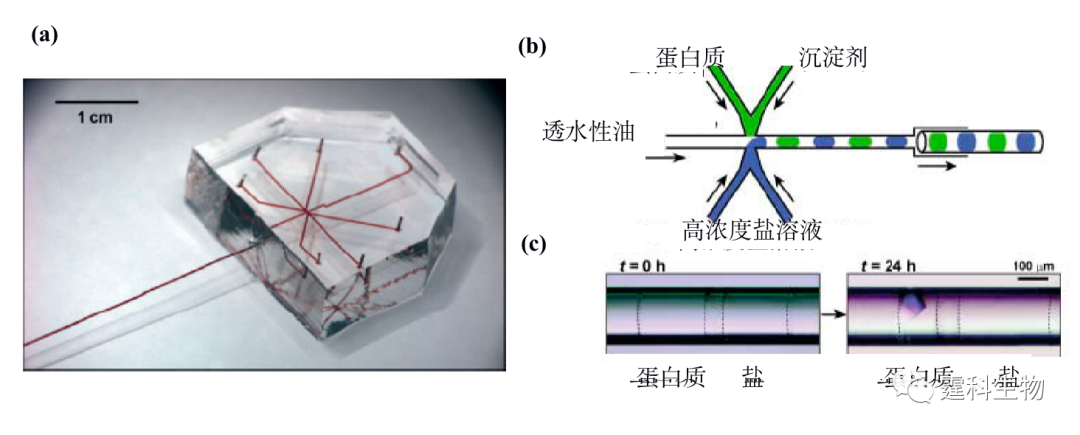
图11-24 不同流速条件下泛素的NMR图[24] 峰a表示原始态的His-68;峰b表示A态的His-68;峰c表示原始态的Tyr-59;峰d表示A态的Tyr-59 11.2.2.3 蛋白质的结晶 了解蛋白质的三维结构不仅具有重要的理论意义,还有助于理解药物的作用机制,以指导药物分子的设计,对新药的研制具有重要的实际意义。当前,X射线晶体衍射是最主要的蛋白质分子三维结构解析手段,因此如何获得高质量的蛋白质晶体一直是困扰科研工作者的难题,也是蛋白质三维结构解析的瓶颈。 蛋白结晶条件的筛选通常需要做大量的实验,以找到蛋白质、沉淀剂和添加剂的合适配比。传统的蛋白质结晶过程主要在微孔板上进行,依赖手动操作,将蛋白质溶液与不同种类和浓度的沉淀剂混合,筛选出最佳结晶条件并用于晶体的生长。该法最大的缺点是蛋白质消耗量大而且操作繁琐。 微流控芯片不仅能够精确的操纵微小体积(nL-pL)样品,并且能够减少蛋白等样品的消耗量,可以方便地改变蛋白质结晶过程中各种溶液的配比。在微流控芯片上,通过液滴技术筛选蛋白结晶条件是一种非常有效的手段,并且通过在线芯片X射线衍射,还可以很方便的检测蛋白晶体质量[25]。蛋白质结晶芯片如图11-25(a)所示,由PDMS和一根外接的玻璃毛细管组成,液滴的形成方式如图11-25(b)所示,每个液滴的体积约为1 nL,上半部分通道用来引入蛋白质溶液和沉淀剂以形成蛋白质结晶液滴,而下半部分通道用来形成高浓度盐溶液液滴,中间用透水性油隔开。由于渗透压的存在,水分会从蛋白质结晶液滴向高浓度盐溶液液滴扩散,使得蛋白质结晶液滴体积减小造成蛋白质的过饱和,从而加速晶核的形成,加快蛋白质结晶速度,约24 h之后就可形成晶体(图11-25(c))。
图11-25 基于液滴技术的微流控蛋白质结晶芯片[25] (a) 芯片实物照片;(b) 液滴形成过程示意图;(c) 蛋白质结晶示意图 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |