|
|
图解微流控|第33期Issuing time:2022-02-15 16:21 微流控芯片实验室在蛋白质研究中的应用(一) 随着人类基因组计划的实施和推进,生命科学研究已进入了后基因组时代,在这个时期,最具有代表性的工作是蛋白质组学研究。蛋白质是生理功能的执行者,也是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用以及蛋白质构象等问题,仍依赖于对蛋白质的直接研究来解决。 蛋白质是由约二十种氨基酸根据不同的排列顺序,以肽键的形式(-CO-NH-)结合而成的具有一定空间结构的链状化合物,蛋白质的可变性和多样性等特殊性质导致了蛋白质研究就技术而言远要比核酸研究复杂和困难得多,因此对研究平台提出了更高的要求。迄今为止,还没有一种研究手段可以解决蛋白质研究的所有问题。 目前,蛋白质研究中采用最为普遍的技术是二维凝胶电泳,通常包括以下几个步骤:1、从细胞提取一组蛋白质;2、通过二维凝胶电泳分离;3、剪切并消化凝胶蛋白斑点;4、通过质谱分析消化后产生的多肽混合物;5、把由此得到的蛋白质谱图和已有的数据库中的蛋白质数据进行比对。但是,该研究方法的整个操作过程繁琐费力,存在着诸多局限性。为了使蛋白质研究更快捷有效,必须寻找新的具有高通量、高准确性、高灵敏度的研究手段。 在过去的十几年中,微流控芯片技术得到快速发展,微流控芯片作为蛋白质研究平台的优越性日益明显。微流控芯片在蛋白质研究中的应用可以用图11-1所示框图概括,在下面各节中,将对其中的各个方面予以较为详细的阐述。
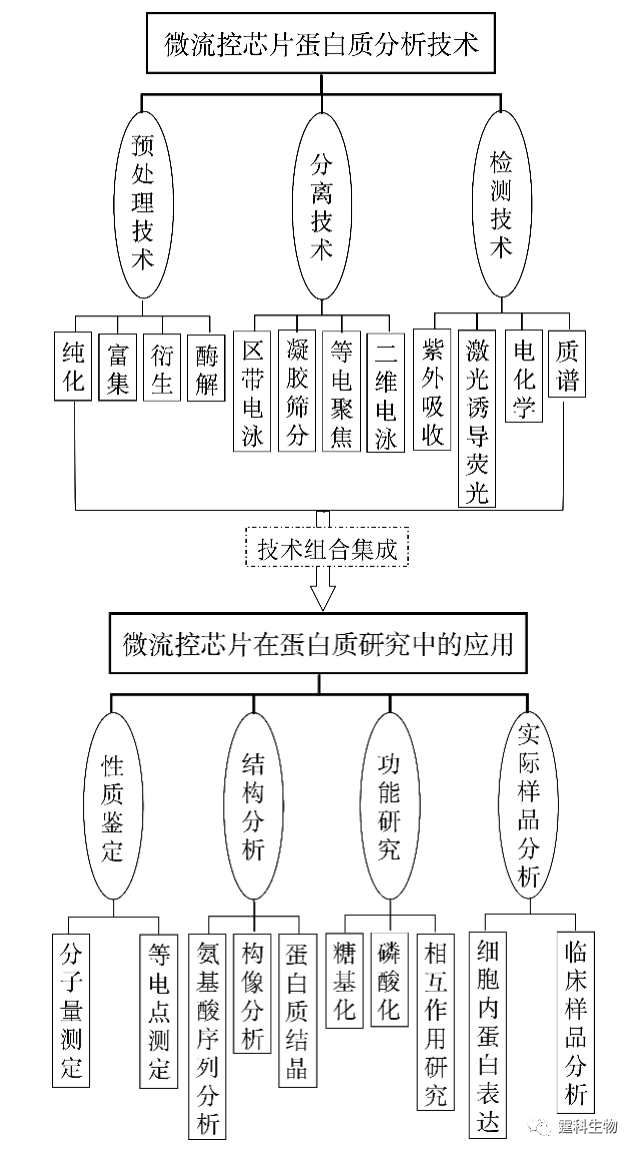
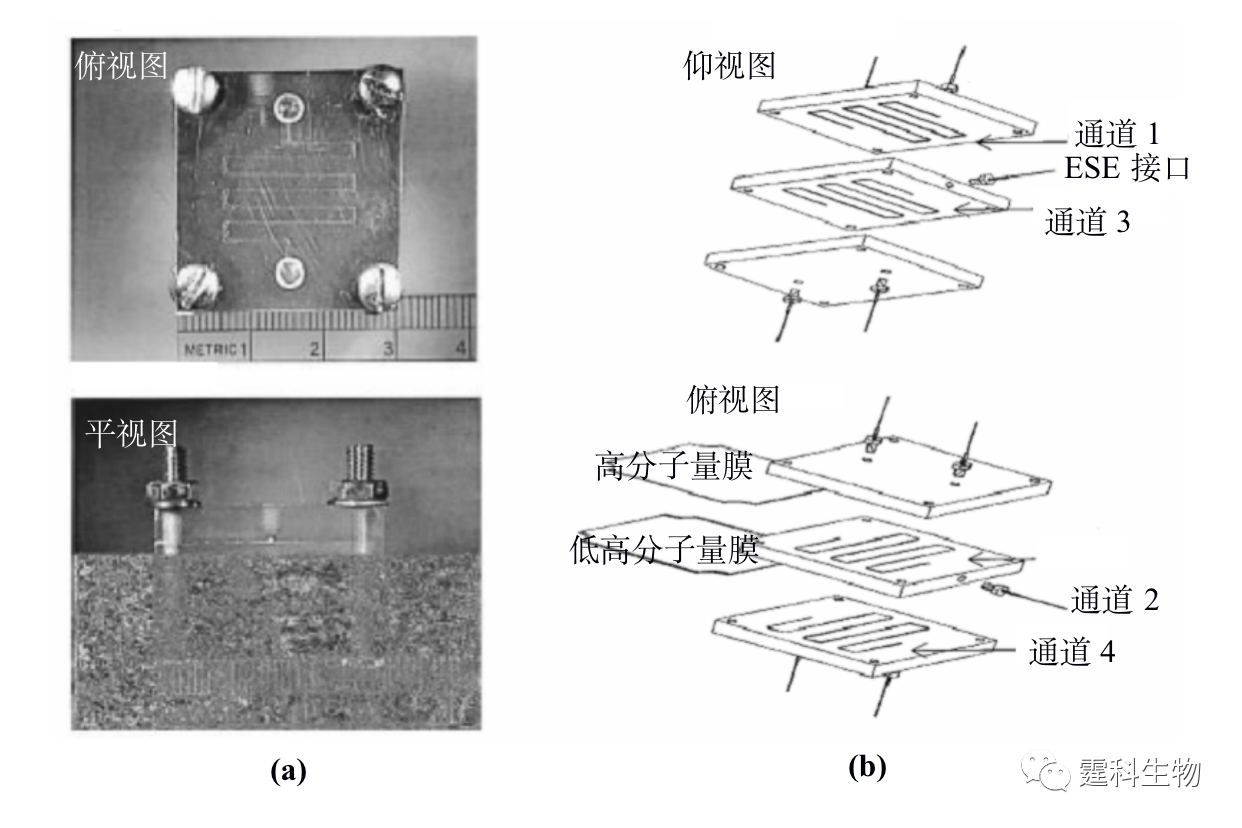
图11-1 微流控芯片蛋白质研究整体框图 11.1 微流控芯片蛋白质分析技术 微流控芯片实验室具有各种操作单元灵活组合、规模集成的特点,传统分析方法难以比拟,很能符合蛋白质组学研究发展的需要[1]。目前,有关蛋白质分析的各种单元技术,包括样品预处理、分离和检测等都已经在微流控芯片上实现。相关的检测技术在前面章节已有具体阐述,在此不再赘述,下面仅对微流控芯片上的蛋白质样品预处理技术和分离技术作一详细介绍,着重关注其有别于其他类型样品的特殊性。 11.1.1 蛋白质样品预处理 样品的预处理是对样品进行分析或研究的重要环节,蛋白质的样品预处理是蛋白质能否被准确测定的一个关键步骤,目前主要涉及蛋白质样品的纯化、富集、衍生和酶解等几个方面。 11.1.1.1 蛋白质的纯化 样品纯化的主要目的是使主要组分同背景基质分离,减少背景杂质对分离或分析的影响。蛋白质样品的纯化主要是进行样品的脱盐处理,这在质谱检测中显得尤为重要,蛋白质样品中的盐类不仅影响离子化效果,还会造成质谱的污染。 ① 微渗析 微渗析是根据分子对透析膜的选择性透过来实现的一种蛋白质脱盐方法。图11-2(a)为蛋白质纯化用双层微渗析微流控芯片[2],即在三层流体通道间加入了两片截留分子量不同的透析膜(见图11-2(b)),上层通道内的蛋白质样品先经过高截留的膜进入中间通道与基质分离,而进入中间层的样品与下层溶液呈逆向流动,其中的盐分和其他小分子干扰物透过低截留的膜进入下层而被除去。将该芯片用于大肠杆菌裂解液中的蛋白质分析,通过两次微渗析后质谱峰的信噪比提高了约20倍。
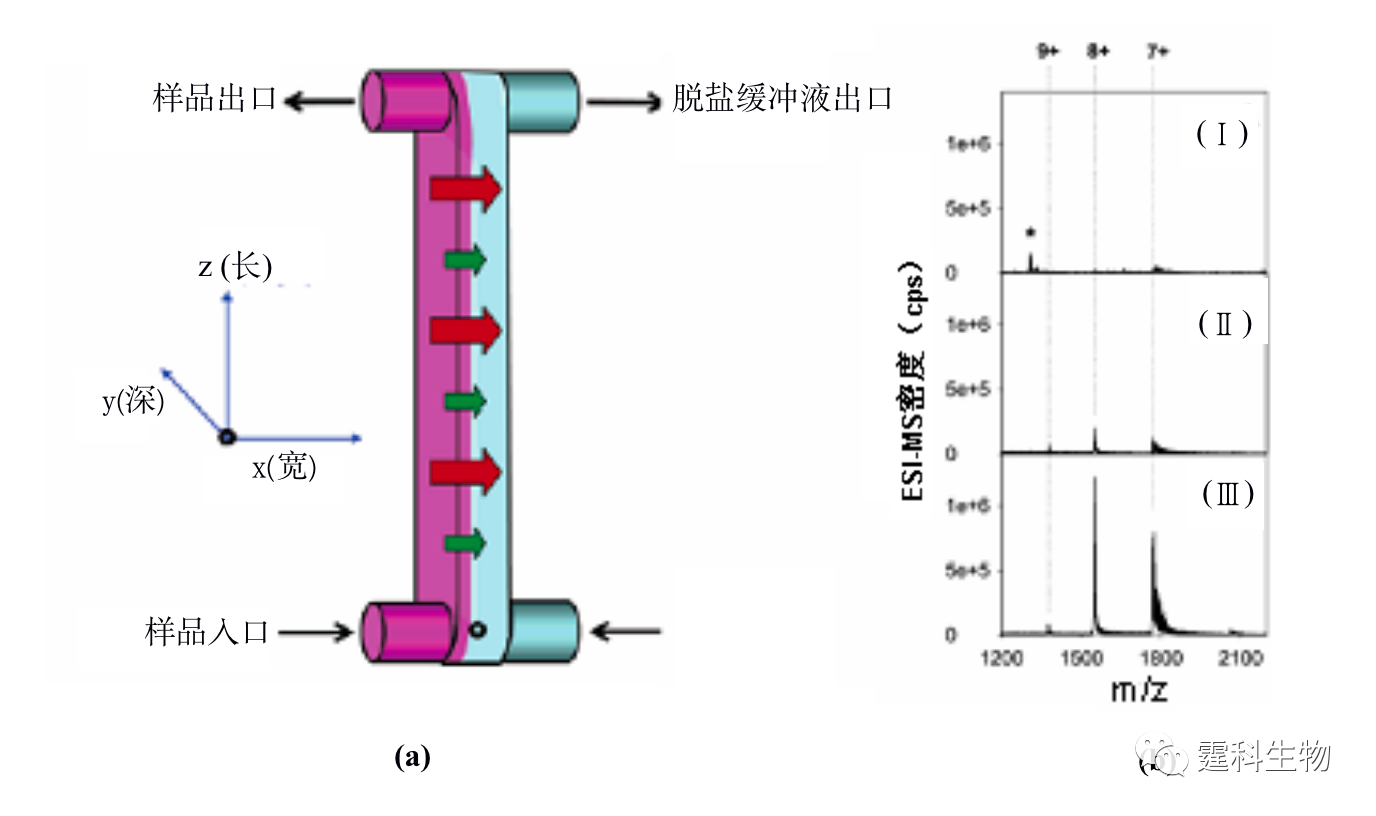
图11-2 双层微渗析微流控芯片[2] (a) 芯片实物图;(b) 芯片结构组成示意图 ② 液-液萃取 液-液萃取是根据样品中蛋白质和杂质小分子扩散系数不同而实现的一种蛋白质脱盐纯化方法。液-液萃取操作相对简单,芯片微通道中流体的层流状态尤其为液-液萃取提供了便利条件,大大加快了蛋白质样品脱盐的速度。图11-3(a)为具有四个出口的矩形微通道构成的液-液萃取芯片[3],样品蛋白质溶液和脱盐缓冲液分别从不同的入 口中注入,通过压力驱动使两种溶液在芯片通道内形成层流,根据样品溶液中蛋白质与盐类小分子对该缓冲液的扩散系数不同,进行扩散脱盐,脱盐的蛋白质在目标分析物出口处被收集后,可进行后续的质谱分析,而大多数盐则随着缓冲液进入废液池中,60 ms内就可以实现蛋白质样品的纯化。脱盐后的质谱结果与非脱盐结果比较,信号明显增强,见图11-3(b)。
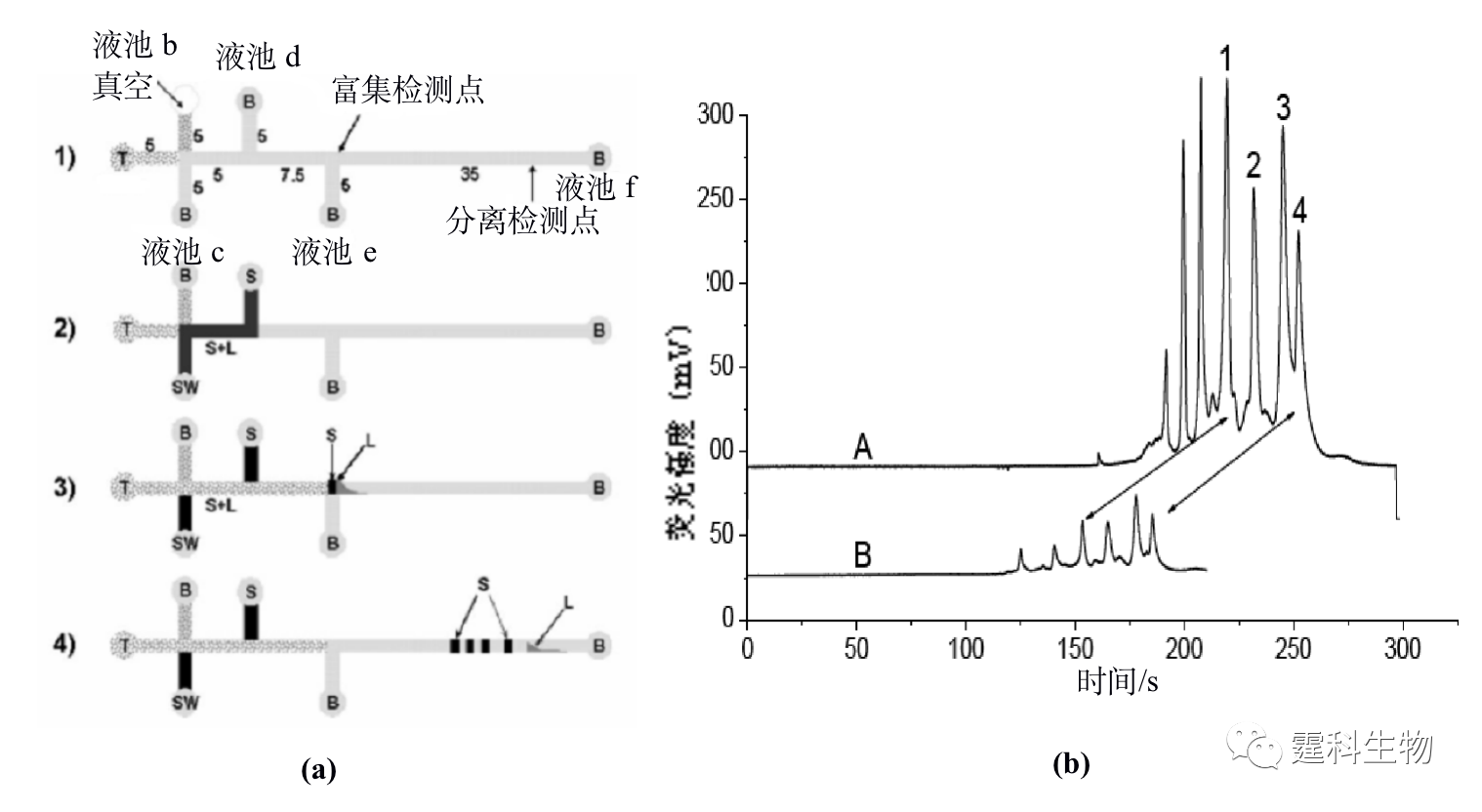
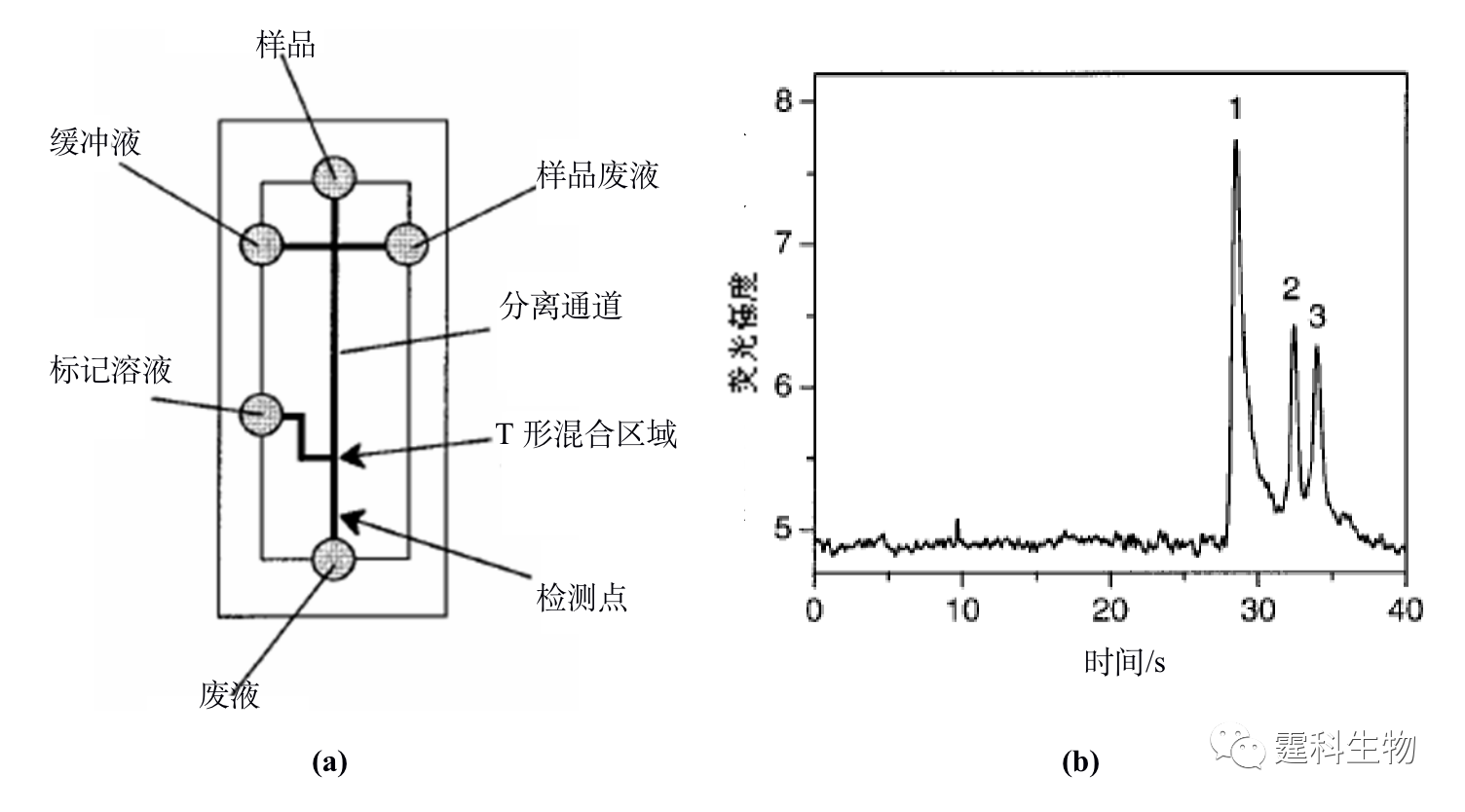
图11-3 蛋白质液-液萃取脱盐微流控芯片及其应用[3] (a) 芯片示意图;(b) 脱盐前后细胞色素C质谱图 图(a)中黑色表示样品,灰色表示脱盐缓冲液,箭头表示流动方向,大箭头扩散速度快的盐,小箭头表示扩散速度慢的蛋白质;图(b)中的(Ⅰ)为内含25 mM NaCl的蛋白质质谱图,(Ⅱ)为一步脱盐后的蛋白质谱图,(Ⅲ)为二步脱盐后的质谱图,随着脱盐的完全,峰高逐渐增加 11.1.1.2 蛋白质的富集 芯片电泳一般进样体积很小,检测光程很短,而蛋白质在实际样品中的含量往往很低,因此,如何降低芯片电泳过程中蛋白质样品的检出限备受关注。开发更高灵敏度的检测器是一个行之有效的办法,但这往往会增加设备的成本,在线富集技术是解决这一问题的有效方法之一。 ① 等速电泳富集 等速电泳作为一种与微通道有良好适应性且兼有分离和富集功能的单元技术受到了人们的普遍关注,主要用作芯片电泳分离前的一种基于电堆积的样品富集技术。作者所在实验室设计了一种无需任何泵和阀,只需5个电极便可以控制蛋白质样品的进样、等速电泳浓缩和无胶筛分分离的蛋白质分析微流控芯片[4],其芯片构型及分析过程见图11-4(a)所示,采用该芯片对四个荧光标记的蛋白质样品进行了富集和分离,与常规的十字通道比较,在不降低分离效率的基础上检测限降低了约40倍,见图11-4(b)。
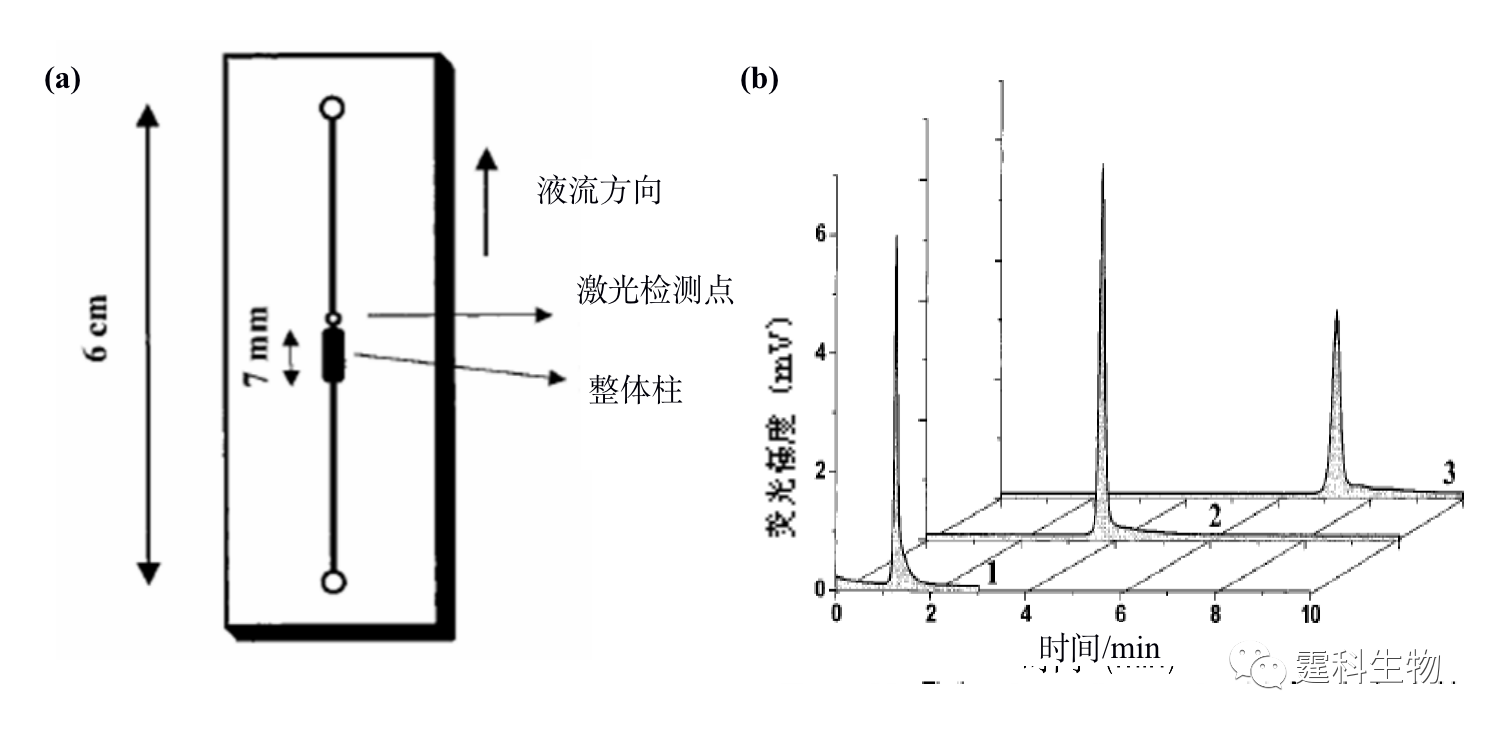
图11-4 微流控芯片蛋白质等速电泳浓缩-凝胶电泳分离及其应用[4] (a) 操作过程示意图;(b) 蛋白质等速电泳富集后分离谱图(A)和十字架进样分离谱图(B)对比结果 图(a)中的数字表示对应的芯片通道长度,单位为毫米,T表示尾随缓冲液,B表示运行缓冲液,S表示蛋白质样品,L表示前导缓冲液,SW表示样品废液 图(b)中峰1为碳酸苷酶,2为卵白蛋白,3为牛血清白蛋白,4为伴清蛋白 ② 固相萃取富集 按照吸附剂存在形式的不同,微流控芯片中的固相萃取可分为开管柱、填充柱和整体柱三种类型。整体柱中的原位聚合法方法简单,光引发可在微通道的确定位置上定位合成整体柱,因此非常适合于微流控芯片平台,已被有效地用于微流控芯片蛋白质固相萃取预富集。图11-5(a)为采用紫外诱导原位聚合反应生成多孔聚合物整体柱的蛋白质固相萃取富集微流控芯片[5],通过不同组成和配比的单体溶液可以制得不同表面性质、孔径大小和孔隙率的整体柱,在制得的疏水性聚合物整体柱固相萃取微流控芯片上,对绿色荧光蛋白质进行富集,其富集率达到103以上,见图11-5(b)。
图11-5 整体柱固相萃取微流控芯片及其应用[5] (a) 芯片示意图;(b)绿色荧光蛋白经固相萃取富集后,不同洗脱流速条件的荧光谱图 图(b)中洗脱液为乙腈/水(1:1),流速为(1)3, (2)1.03, (3)0.53 μL/min ③ 多孔膜富集 微流控芯片上的多孔膜富集技术是目前采用较多的一种蛋白质富集技术,其原理是基于多孔膜对蛋白质大分子的选择性截留作用。在芯片上利用多孔膜富集蛋白质,既可以直接采用商品化滤膜,也可以通过微加工和原位合成法制作各种多孔类膜结构,商品化膜在玻璃等刚性材质的芯片上集成有一定的难度,因此更多的是采用后一种方法制得的类膜多孔结构来进行蛋白质的在线富集。 图11-6(a)所示的是利用激光诱导原位聚合方法,在玻璃微通道内部直接生成的厚度约50 μm的多孔膜[6],该多孔膜可以截留相对分子量大于5700的蛋白质,而小的缓冲液离子可以自由通过,其过程如图11-6(b-d)所示,100 s内蛋白质样品可获得上万倍的富集效率。
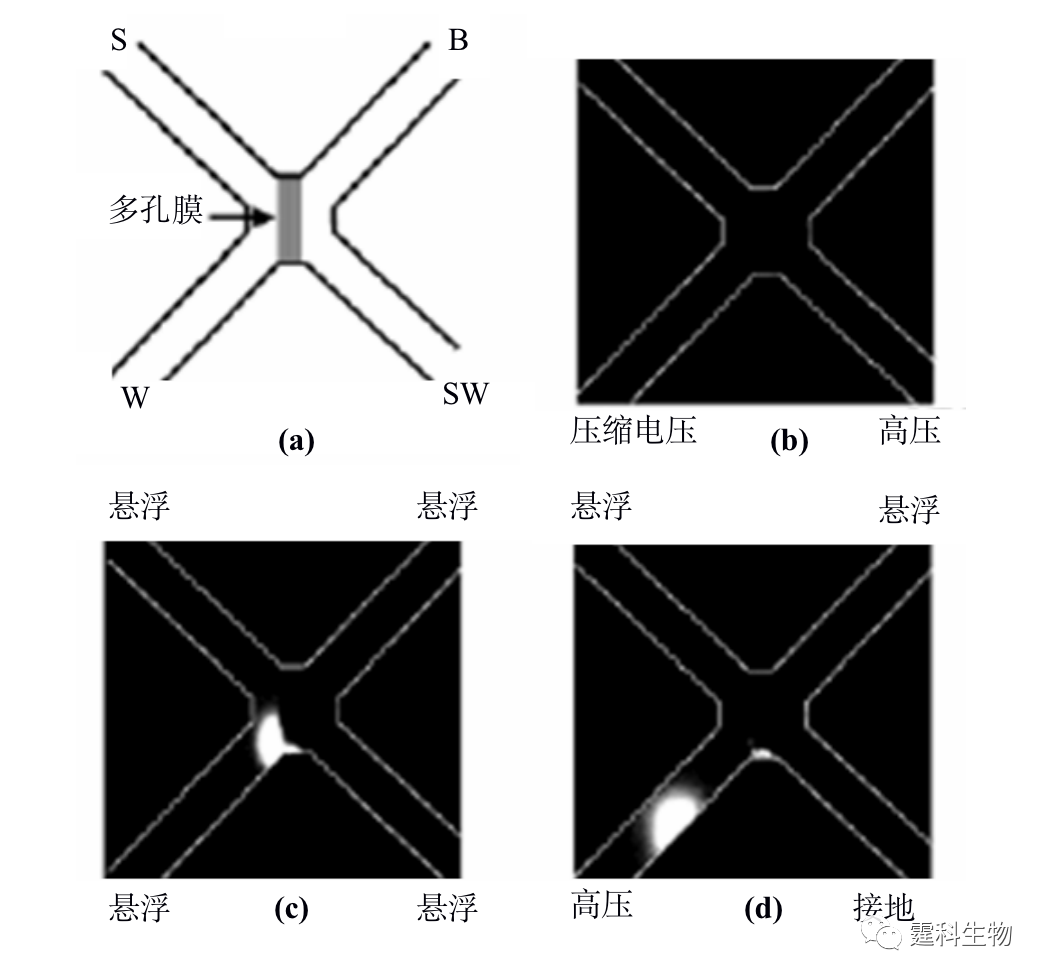
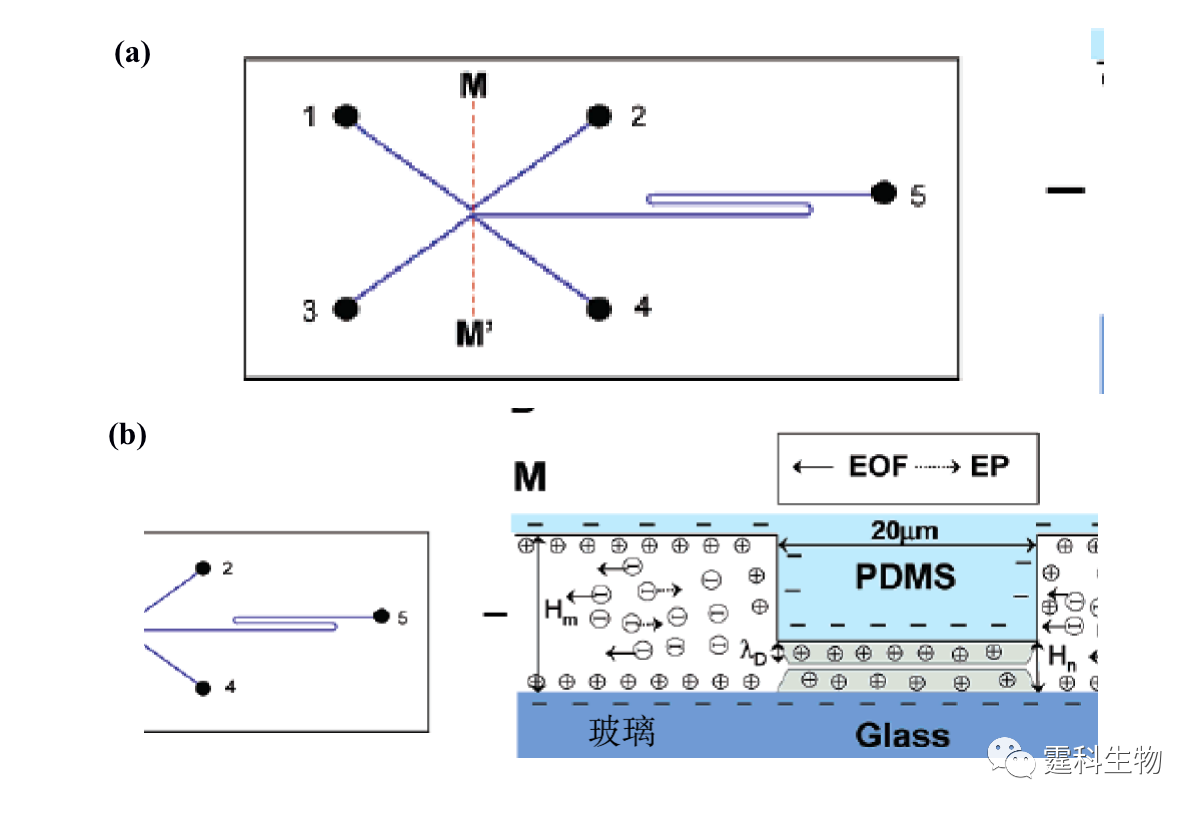
图11-6 膜富集微流控芯片及富集过程[6] (a) 芯片通道内激光诱导原位聚合膜示意图;(b-d) 膜富集过程照片 图(a)中S对应样品池,B对应缓冲液池,W对应缓冲液缓冲液废液池,SW对应样品废液池; (b) 上样前照片;(c) 上样后照片;(d) 富集后进样照片,图中白色的为样品的荧光照片 ④ 纳米通道富集 利用玻璃和PDMS封接处所形成的纳米级通道来进行蛋白质的富集,是目前较为新颖的富集方法。芯片设计如图11-7(a)所示[7],上下两个通道通过厚度为20 μm的PDMS相互隔开,将蛋白质样品置于3和4样品池内,1和2为样品缓冲液池,当两边加上200 V电压后,带负电荷的蛋白质样品在交界处的样品池一侧发生富集,30 min后蛋白质的富集倍数高达106。这可能是由于纳米级的通道高度和偶电层相当,因此在玻璃和PDMS封接处会产生一个的阳离子通道(如图11-7b所示),为保持电中性,带负电荷的蛋白质受到排斥而不能通过该通道,由此在该交界处发生富集。
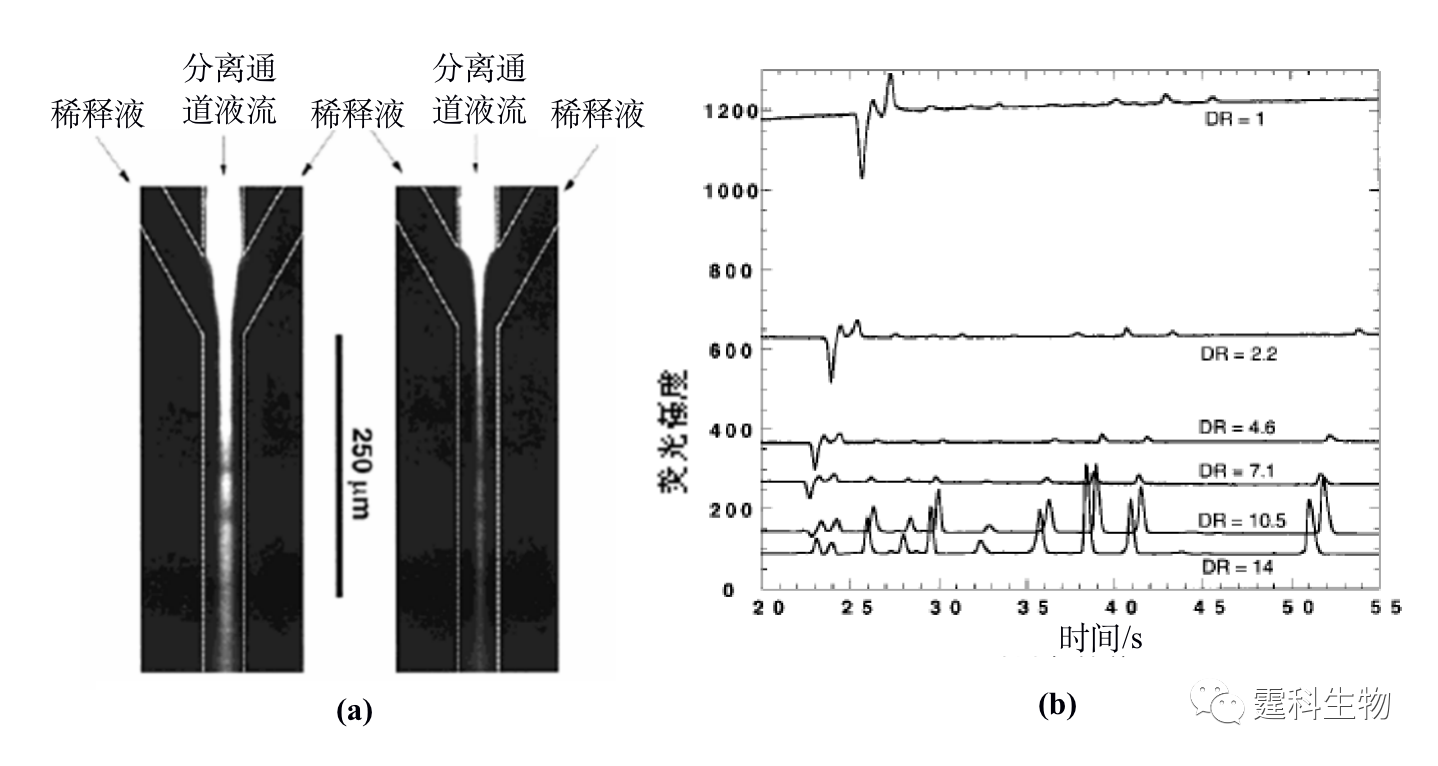
图11-7 纳米通道富集微流控芯片及富集原理[7] (a) 芯片示意图;(b) M-M’对应的剖面及富集原理示意图 11.1.1.3 蛋白质的衍生 绝大部分蛋白质本身不带荧光,为了满足微流控芯片常用的激光诱导荧光检测器的要求,蛋白质样品通常需要进行荧光衍生。衍生可以是柱前的(先衍生再分离),也可以在线的(边衍生边分离),还可以是柱后的(先分离再衍生)。目前微流控芯片蛋白质的柱前衍生一般是离线进行的,因此在此不作讨论,下面主要介绍微流控芯片上完成的蛋白质在线衍生和柱后衍生。 ① 在线衍生 在线衍生是将荧光染料加入到蛋白质样品溶液中,不需要额外的衍生时间,在蛋白质分离的过程中就发生衍生反应,因此该衍生反应一般采用衍生速度快的非共价标记染料,如Nano Orange,Sypro red等。这一类染料本身荧光较弱,只有当它嵌入蛋白质或SDS-蛋白质复合物的疏水部分时,才被激发出很强的荧光,但是该类染料选择性差,往往会和一定浓度的SDS胶束疏水部位结合而产生很强的背景荧光。为了消除这种影响,可以通过在微流控芯片分离通道的末端加工出Y形通道结构来稀释高浓度的SDS[8],使其在检测点前低于其临界胶束浓度,从而减少荧光染料与SDS胶束结合产生的背景,如图11-8(a)所示。随着稀释倍数的增加,背景荧光逐渐降低,蛋白质的检测灵敏度增加(图11-8(b))。利用该方法,芯片上蛋白质衍生和SDS稀释步骤都在100 ms内完成,比传统使用SDS-PAGE手段快了约104倍,对碳酸酐酶的检测灵敏度达到30 nM。
图11-8 微流控芯片蛋白质在线衍生稀释图[8] (a) 分离通道流出液被Y通道稀释液稀释的荧光照片图;(b) 随着稀释倍数(DR)的增加背景荧光逐渐降低 ② 柱后衍生 柱后衍生是指在样品实现分离之后再行衍生反应,因此要求衍生过程能快速、重现地进行,同时也要求衍生试剂本身的背景信号低,一般采用衍生速度快的非共价标记染料。目前,在微流控芯片上实现蛋白质的柱后衍生是Liu等人报道的[9],在如图11-9(a)所示的微流控芯片上,采用一个T形结构的通道来实现分离通道的流出液和衍生试剂的汇流。Nano Orange为柱后衍生试剂,得到三个模型蛋白的芯片电泳分离谱图如图11-9(b)所示,其浓度检测限小于0.5 pg。
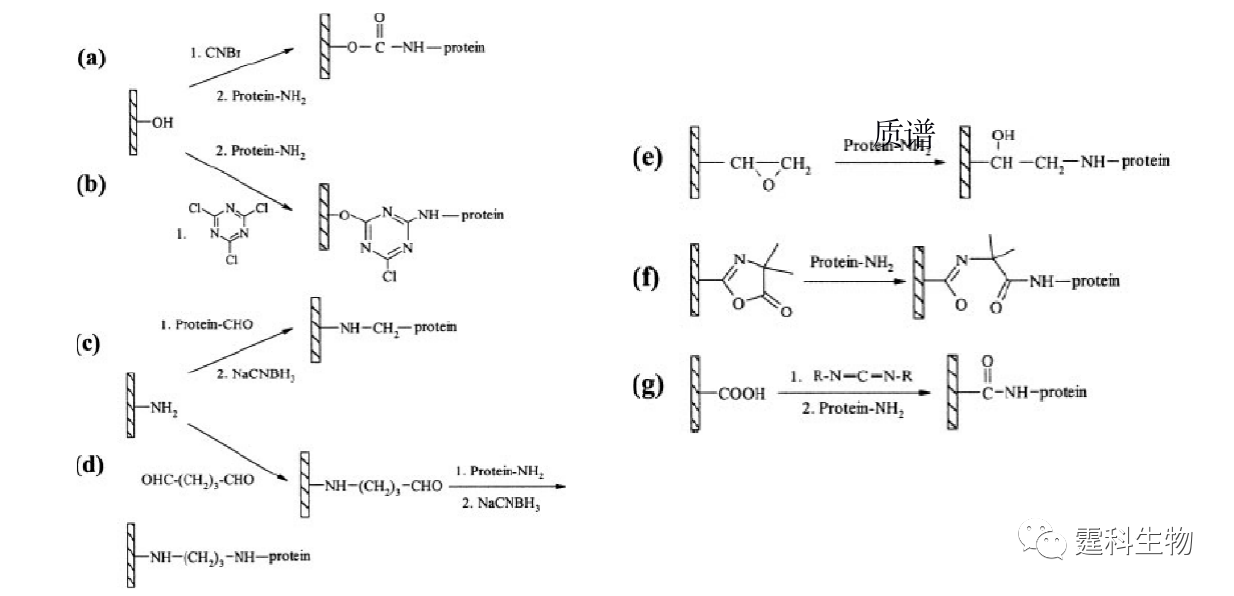
图11-9 蛋白质柱后衍生微流控芯片及其应用[9] (a) 蛋白质柱后衍生芯片示意图;(b) 柱后衍生蛋白质芯片电泳分离谱图 1.α-乳白蛋白;2.β-乳球蛋白 B;3.β-乳球蛋白A 11.1.1.4 蛋白质的酶解 蛋白质组分析的方法通常是将蛋白质大分子酶解为多肽,经由质谱检测得到肽谱,通过分析肽谱并进行肽链测序得到蛋白质分子的结构和组成。胰蛋白酶因其高度专一性和稳定性常被用于蛋白质的酶解,通过吸附、包埋、交联、共价键合等方法将胰蛋白酶固定在特定的载体上以形成固定化酶反应器,是目前最常用的蛋白质酶解方法。与溶液中的蛋白质酶解反应相比,固定化的酶具有更高的酶/底物比、更高的酶解效率、可重复使用并能减少酶的自身降解等优点。此外,使用固定化酶反应器还可以避免样品的手工处理,减少蛋白样品被污染的可能性。在微流控芯片上集成胰蛋白酶反应器不仅可以提高蛋白质酶解反应速率,而且也有利于发展高通量的样品处理方法。芯片上固定化胰蛋白酶反应器的固相载体可有多种形式,如微通道表面、微珠、原位聚合整体柱、溶胶-凝胶及聚合物膜等。 ① 芯片内壁固定化胰蛋白酶反应器 在芯片内壁进行胰酶固定化一般是采用共价键合的方法,将胰蛋白酶通过化学键结合在经过处理的芯片表面,形成开管式固定化胰蛋白酶反应器[10]。这种方法操作相对简单,其中较常用的不同材料芯片的内壁固定化过程如图11-10所示。该方法可能会在一定程度上影响酶的活性,而且比表面积较小,所以一般酶解速度较慢。
图11-10 不同表面基团微流控芯片通道内壁的胰蛋白酶固定化过程[10] (a)和(b)表示材料表面为羟基时的蛋白质固定化过程;(c)和(d)表示材料表面为氨基时的蛋白质固定化过程;(e) 表示材料表面为环氧基时的蛋白质固定化过程;(f)表示材料表面为酰氨基时的蛋白质固定化过程;(g)表示材料表面为羧基时的蛋白质固定化过程 ② 微珠固定化胰蛋白酶反应器 微珠具有比微通道更大的比表面积,被广泛用于微流控芯片固定化胰蛋白酶的载体。如图11-11所示[11],将表面键合有胰蛋白酶的微珠填充在微流控芯片的通道或样品池中,从而形成固定化胰蛋白酶反应器。该酶反应器比表面积大,室温下3~6 min 内就可以实现蛋白质的酶解,对细胞色素C酶解后的片断进行芯片电泳分离和ESI-MS检测,其氨基酸序列的覆盖率达到92%。
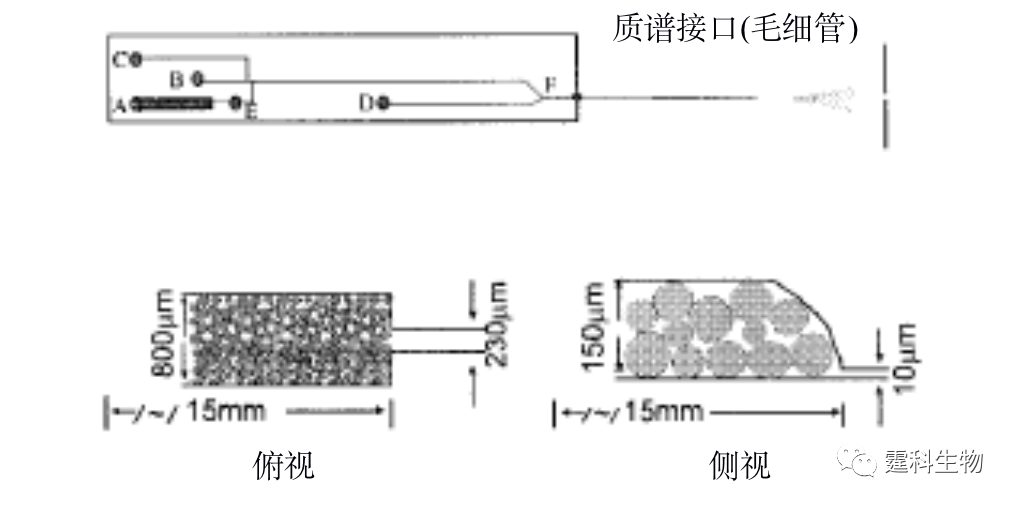
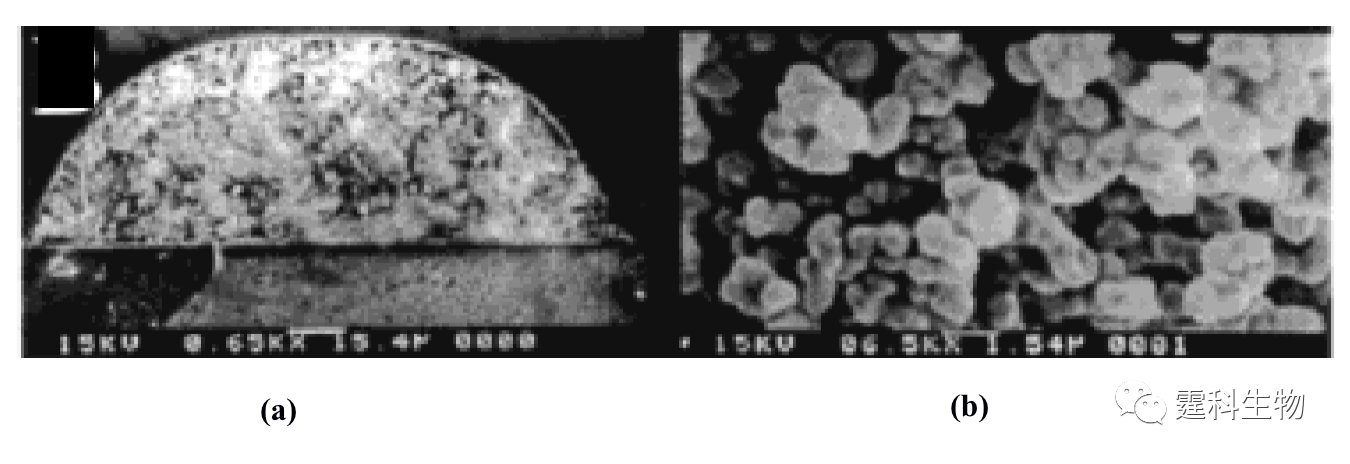
图11-11 微珠填充固定化胰蛋白酶反应器芯片示意图[11] 微珠填充需要在通道内微加工出坝等微结构,操作相对麻烦。因此,有人采用纳米级的磁性颗粒作为固定化材料[12],该方法不需要在芯片通道内加工坝结构,只需要两个极性相反的磁铁放置在通道的两端,磁性颗粒就可以固定在通道内而不会被溶液冲走。 ③ 原位聚合整体柱固定化胰蛋白酶反应器 原位聚合整体柱较适合微流控芯片平台,通过光引发可以在确定的位置上定位合成整体柱。图11-12所示[13]的是采用紫外光照聚合法,在微流控芯片通道内制备出的孔径为0.5~2.0 µm的多孔聚合物整体柱,以该整体柱为固相载体可以进行胰蛋白酶的固定,并用于在线的蛋白质酶解。
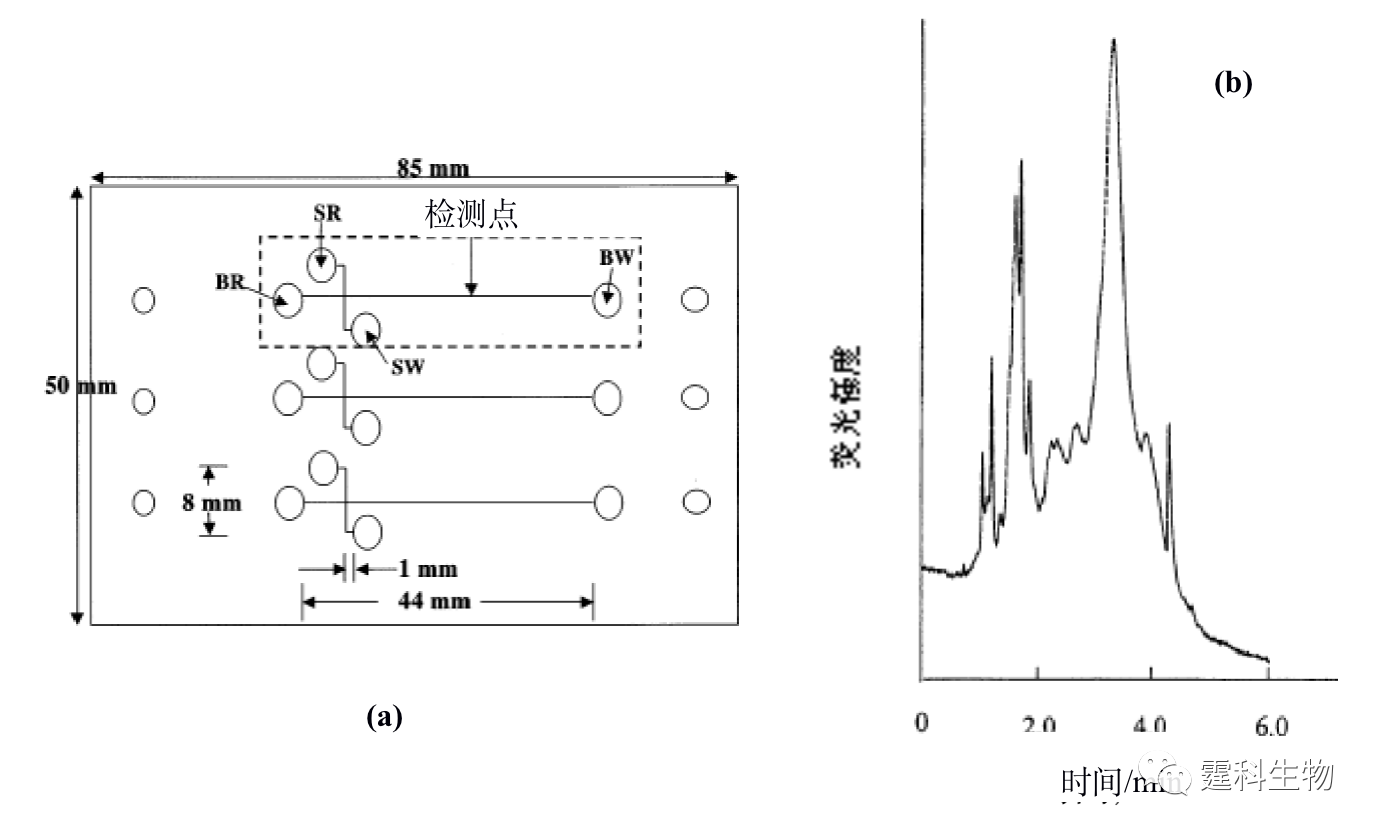
图11-12 微流控芯片通道内形成的整体柱扫描电镜照片[13] (a) 放大650倍;(b) 放大6500倍 ④ 溶胶-凝胶固定化胰蛋白酶反应器 Sakai-Kato等[14]将胰蛋白酶通过原位溶胶凝胶法包埋于PMMA芯片的样品池内(见图11-13(a)),蛋白质经胰蛋白酶解后得到的肽段可以直接进行在线的芯片电泳分离。与传统的酶解方法相比,该酶解过程所需时间大大缩短,整个分析过程小于5 min(如图11-13(b)所示)。
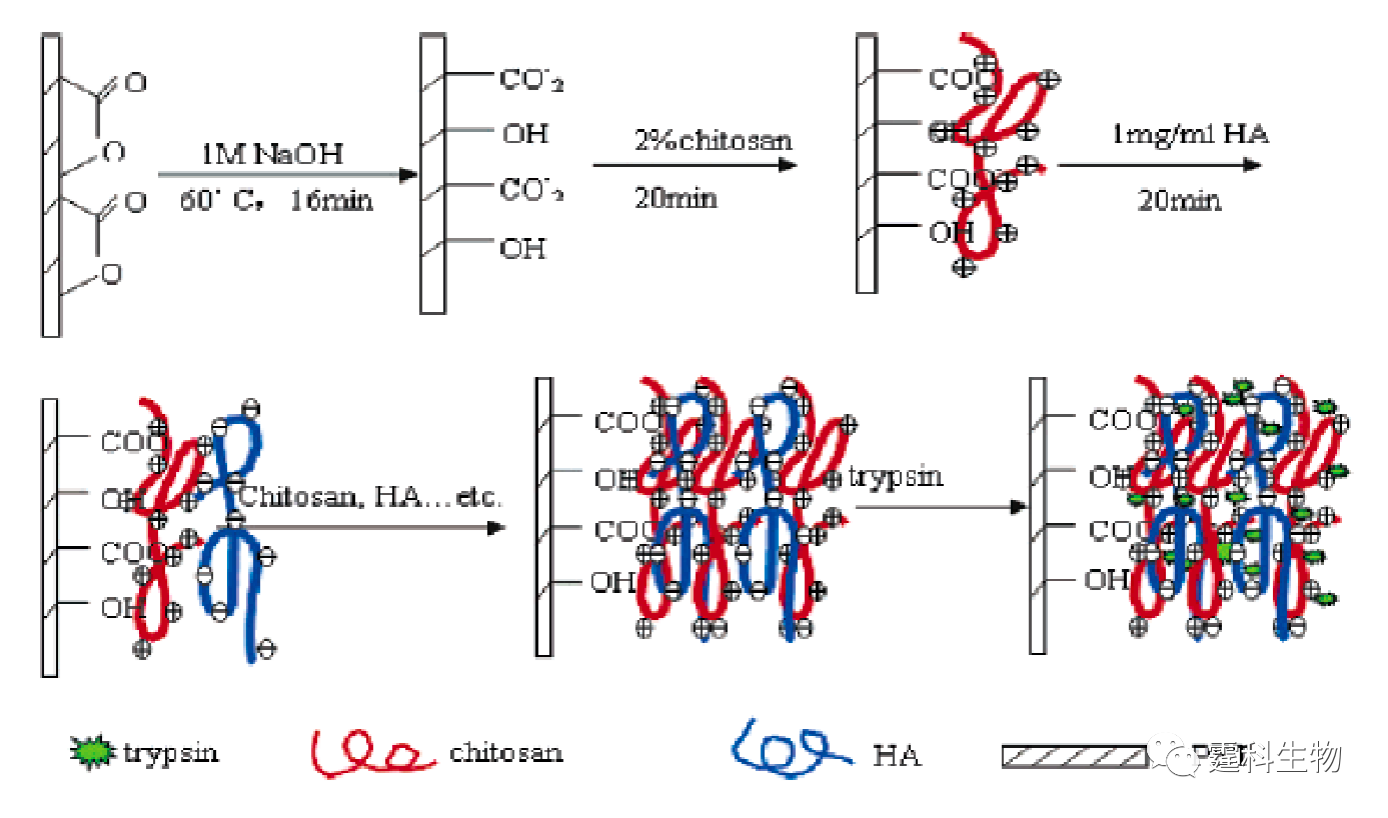
图11-13 溶胶-凝胶固定化胰蛋白酶反应器芯片及其应用[14] (a) 芯片示意图;(b) 酪蛋白酶解产物的芯片电泳谱图 图(a)中SR表示样品池,BR表示缓冲液池,SW表示样品废液池,BW表示缓冲液废液池 ⑤ 膜固定化胰蛋白酶反应器 多孔膜固定化酶反应器能将酶的催化特性与多孔膜的分离性能相结合,使酶解反应和产物分离同时进行,从而加快酶解反应的速率,提高转化率。Gao等[15]将聚偏二氟乙烯(PVDF)集成在微流控芯片上,利用聚偏二氟乙烯(PVDF)与蛋白分子的疏水相互作用,将胰蛋白酶吸附在多孔PVDF膜上,当样品被注射泵推过膜时受胰蛋白酶作用水解,得到的肽段经等速电泳富集后再借助芯片区带电泳分离,最后进入质谱分析。使用该装置可以在几分钟内进行蛋白质的鉴定,而且消耗的蛋白量仅为纳克级。最近,Liu等[16]报道了一种多层自组装膜用于固定化胰蛋白酶,鉴于带正电荷的壳寡糖(chitosan)和带负电的透明质酸(HA)会在聚乙烯对苯二酸酯塑料(PET)表面发生自组装作用,因此可以在PET塑料芯片内壁形成一层具有生物相容性的微网络结构自组装多层膜,而胰蛋白酶则可以在多层膜上吸附固定,具体过程如图11-14所示。他们将该固定胰蛋白酶反应器用于细胞色素C的酶解,酶解时间小于5 s,与在溶液中进行的酶解反应相比,其酶解速度要快上千倍,与MALDI-TOF质谱联用其检测限达0.5 ng/µL,说明该固定化胰蛋白酶反应器具有较高的酶解效率。
图11-14 多层自组装膜固定化酶反应器形成过程示意图[16] 图中的箭头表示反应路线 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |