|
|
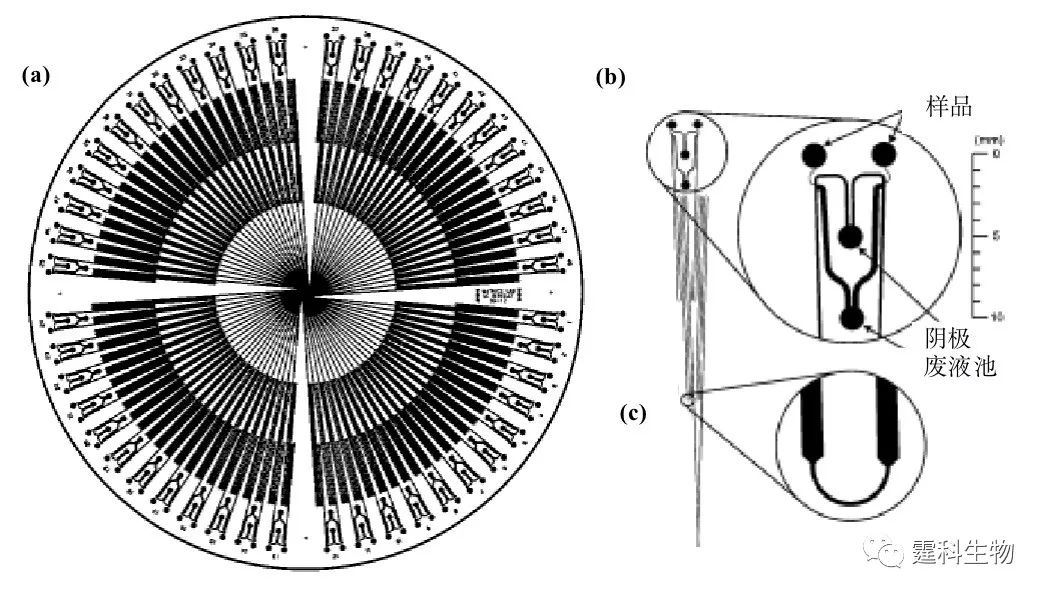
图解微流控|第31期发表时间:2022-01-18 14:58 微流控芯片实验室在核酸研究的应用(三) 10.3 DNA测序 DNA测序是指DNA分子中核苷酸排列顺序的测定,是核酸序列分析的根本手段。利用DNA测序可获得DNA序列的信息,研究疾病的发病机制,它可应用于遗传学、法医学等的研究。 阵列毛细管电泳是完成人类基因组工程DNA测序时采用的主流技术。该技术所采用的主要测序方法为Sanger(又称链结构转化法)法。这种传统DNA测序方法面临着大规模应用时成本、仪器等方面因素的挑战,而微流控芯片的技术则可能将DNA测序的步骤集成在芯片上完成,达到高通量、集成化和微型化的目的。现阶段,基于Sanger法的DNA测序流程包括细菌转化、培养、筛选克隆、DNA复制、Sanger双脱氧染料末端标记、产物纯化和电泳分离等几个步骤,整个测序过程繁冗,运行成本高,仪器设备庞大,不适于大规模基因组DNA测序应用的需要。其中由酶介导的DNA扩增反应和测序过程标记等还要消耗大量昂贵试剂。微流控芯片实验室的出现在一定程度上满足了这一实际需求,并有可能将测序过程的几个关键步骤集成在一块芯片上完成,以达到高通量、集成化和微型化的目的。 微流控芯片DNA测序研究,以芯片电泳分离为基础,早期多有研究,阵列微流控芯片的出现显示了在芯片上实现DNA测序的可行性[25]。图10-20所示的是96通道阵列微流控芯片,分析长度为41 000 bp的序列仅用25 min,准确率达99%,对M13mp18 单链DNA序列测序的部分结果见图10-21[26]。
图10-20 96通道阵列微流控测序芯片示意图[26] (a) 为芯片全局图,圆盘直径150 mm,分离通道折叠延长至16 cm,呈放射状排列;(b) 为进样处放大图,两样本池共用一个废液池;(c) 通道转角处采用弯道设计以减少几何尺寸所引起的带宽
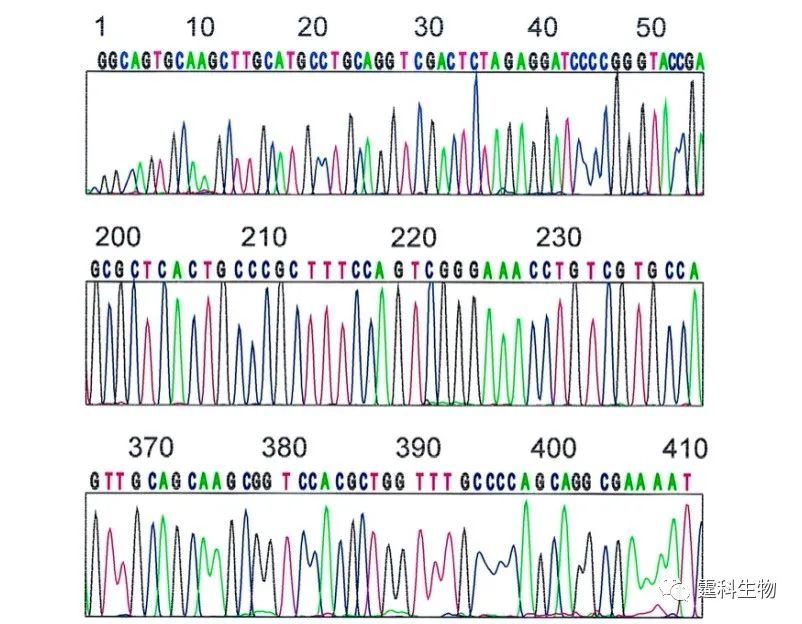
图10-21 96通道阵列芯片对M13mp18单链DNA测序结果[26] 每个峰代表一个碱基,DNA碱基(A 、T 、C、G)分别用能量转移染料进行四色荧光标记 如图10-22所示,将温度循环反应、纯化和电泳集成于一个直径100 mm芯片上可构建一个微流控测序芯片,实现PCR扩增、捕获/纯化和高分辨率测序等功能的集成,35 min内分析556 bp的样本,正确率为99%,样本耗量仅为1 fmol[27]。
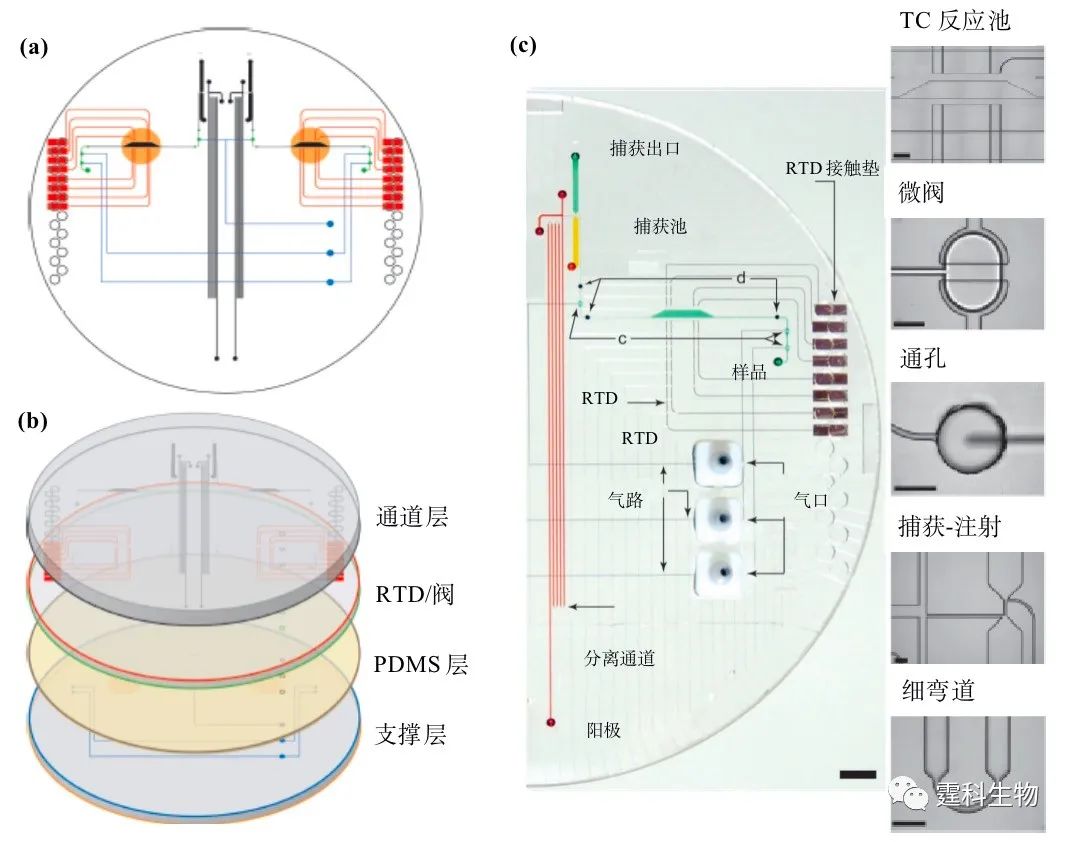
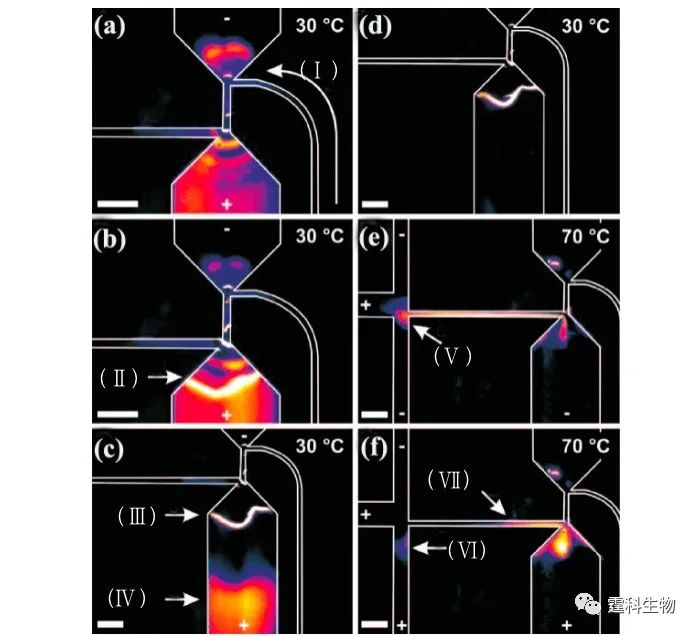
图10-22 微流控测序芯片图[27] (a) 芯片俯视图;(b) 芯片展开图;(c) 芯片功能单元示意图 测序芯片系统由上两层玻璃芯片即通道层和RTD/阀层热封接在一起,含加热单元、反应池和电泳通道等,通过PDMS层和最下层含微泵控制通道的支撑层玻璃芯片可逆封接。反应物在反应池中经35个温度循环后进入固定有和引物互补序列核苷酸的捕获柱,经纯化后导入分离通道进行分离。芯片上集成有隔膜微阀和薄膜加热/传感器。 图10-23展示了微流控测序芯片中样本捕获、纯化和注入步骤: (a)荧光标记的样本通过微泵注入(Ⅰ)区; (b)在电场作用下进入捕获柱,样本在(Ⅱ)处(捕获柱)被捕获; (c)预期得到的序列被捕获在(Ⅲ)处,在(Ⅳ)处洗去杂质; (d)纯化和浓缩的样本准备进样; (e)70℃时样本被注射进入(Ⅴ)处(通道连接处); (f)1 nL样本被注射入分离通道(Ⅵ)处进行电泳分离,(Ⅶ)处其余样本被反势电压抑制。
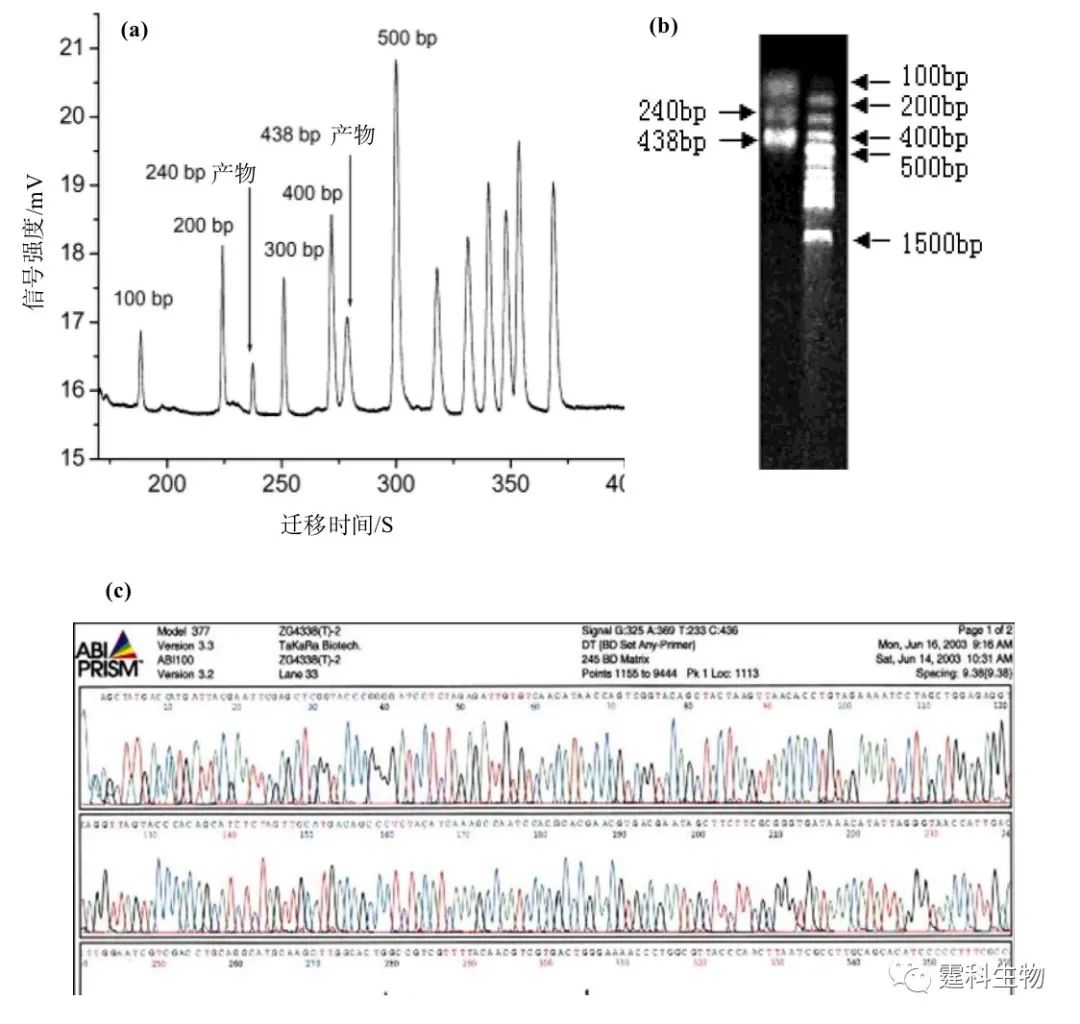
图10-23 样本捕获、纯化和注入步骤荧光图 10.4病原体基因检测 病原体(pathogen)是能引起疾病的微生物和寄生虫的统称,和人类的疾病密切相关,病原体基因检测指的是对外源性病原体(病毒或细菌)基因的直接检测。 人类疾病可能是直接由内因引起的,如基因结构的改变,可以利用基因突变检测方法来诊断。也有可能是外因诱导的,如致病病原体入侵,需要用病原体基因检测手段来做基因诊断。现阶段微流控芯片在核酸研究中的应用有很大一部分围绕着病原体基因检测展开。 传统基于PCR基础上的病原体基因检测方法涉及到样品前处理、DNA或RNA提取、PCR扩增和电泳分离等多个步骤。微流控芯片的功能集成特征为病原体基因检测提供了一条新的途径。 例如,微流控芯片可对SARS病毒PCR扩增产物检测。作者所在课题组尝试在芯片上将PCR反应与电泳分离过程相集成,完成了对18例临床样品SARS病毒的快速检测[28]。 SARS病毒是一种新型的核糖核酸(RNA)病毒,具有明显传染性,主要通过呼吸道传播,病程发展较快,死亡率较高。实验中以SARS病毒cDNA作阳性对照,副流感病毒作阴性对照,通过双重PCR反应检测了18例临床SARS诊断病人咽拭子样品,并与常规逆转录PCR(RT-PCR)结果进行比较。SARS病毒阳性对照标本的芯片电泳结果见图10-24,其中240 bp和438 bp为SARS病毒RT-PCR扩增产物,并经过DNA测序验证,显示出微流控芯片用于SARS病毒检测的潜在能力。
图10-24 SARS病毒阳性对照样本PCR扩增产物微流控芯片和平板电泳图[28] (a) SARS病毒阳性对照样本芯片电泳图,病毒扩增产物为240 bp、438 bp;(b) PCR产物的琼脂糖凝胶电泳图谱;(c) 测序结果证实PCR产物序列同SARS病毒基因组一致 利用微流控芯片将等速电泳(ITP)和区带电泳(ZE)两种电泳模式相集成(ITP-ZE)是一种有效提高灵敏度的检测方式,作者所在课题组通过ITP过程中样品的预浓缩来提高病原体基因检测灵敏度。在ITP过程中,由于双链DNA在筛分介质中的迁移速度介于前导电解质和尾随电解质之间,可以实现对样品区带的压缩,随后,把压缩后的区带导入区带电泳中分离。这种方法通过进样量的增加既提高了检测灵敏度,又不影响分离效率。 利用该方法,完成了对200例临床实际样品乙型肝炎病毒(HBV)的检测和基因分型,并与传统方法进行比较[29]。图10-25是一个集成有ITP预浓缩功能的DNA分离芯片,样品预浓缩及分离的整个过程通过一个多电极的微流控芯片分析系统来控制。该方法可以检测到模板拷贝数为101—108 /μL的HBV基因产物。与传统的两轮巢式PCR-凝胶电泳方法相比,不仅缩短了分析时间,也减少了试剂和样品消耗量。
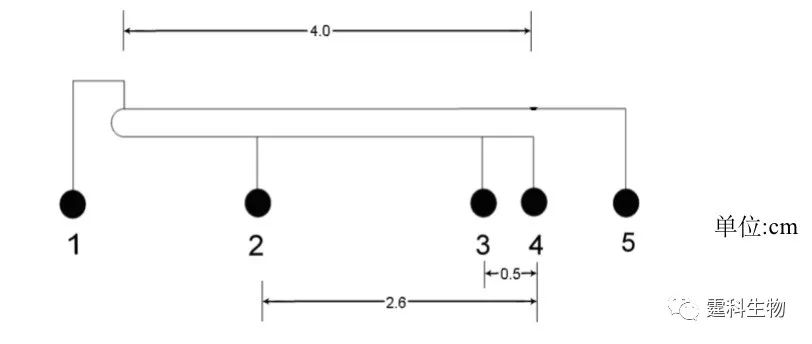
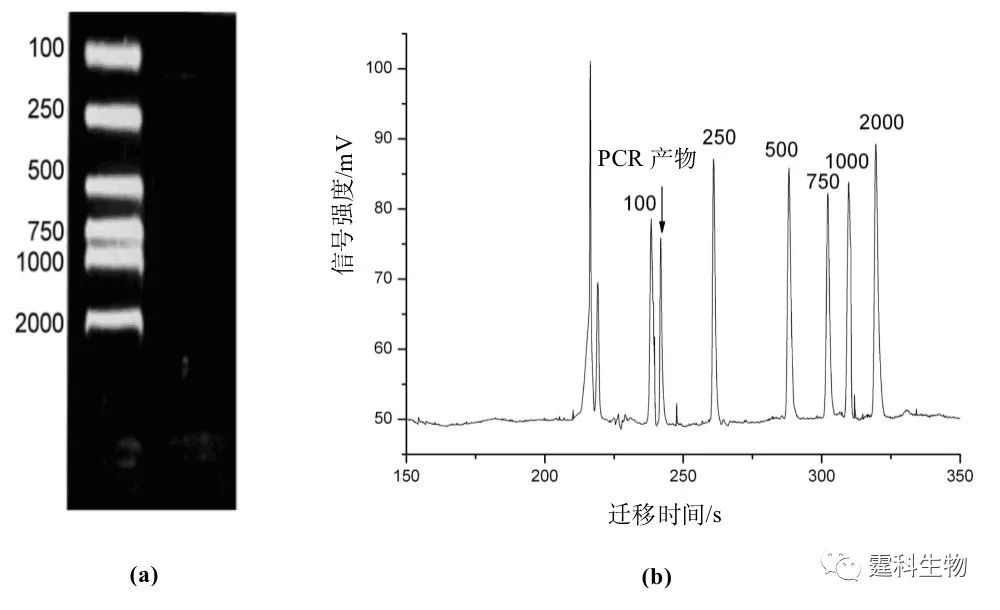
图10-25 具有ITP预浓缩功能的集成化微流控芯片[29] 图中1,2和5号池加入前导缓冲液,4号池加尾随缓冲液,3号池为样品池。该方法可以检测到模板拷贝数为101—108 /μL的HBV基因产物。与传统的两轮巢式PCR-凝胶电泳方法相比,不仅缩短了分析时间,而且减少了试剂和样品消耗量 图10-26是同一样品的巢式PCR产物用凝胶电泳检测的结果以及单轮PCR产物用ITP预浓缩芯片检测的结果。可以看出,集成了ITP预浓缩的芯片,可检测到120 bp的基因产物,而凝胶电泳的检测结果却没有显示出该基因产物。
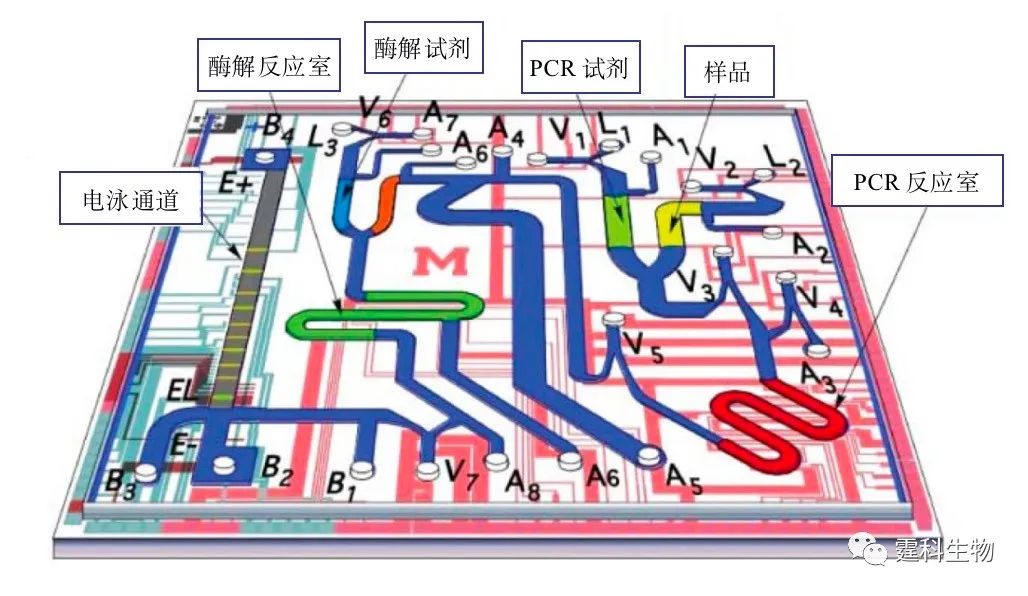
图10-26 集成ITP预浓缩的微流控芯片HBV基因分型检测结果[29] (a) 2%琼脂糖凝胶电泳结果;(b) 集成ITP预浓缩微流控芯片(ITPZE)结果 前导缓冲液为15 mM HCl/36 mM咪唑,pH 7.0;尾随缓冲液为20 mM HEPES/40 mM 咪唑;pH 7.2.筛分介质:2% HPMC;荧光探针为GeneFinderTM 微流控芯片也可用于流感病毒的基因检测。图10-27所示的硅-玻璃微流控芯片系统集成微阀、微加热器、温度传感器、电泳分离等多个单元过程,在一块芯片上可完成两个温控反应(PCR反应、限制性酶切反应)及电泳分离过程[30]。芯片运行时,待测样品和PCR缓冲液通过芯片入口(L1、L2、L3)进入微通道内,溶液混合后到达第一个反应区(PCR反应室),该室由相变阀(V3、V4)作为开关控制来保持封闭状态,PCR反应温度由底层薄膜加热片和温度传感器来控制,经过一定热循环反应后,阀门打开,PCR反应产物进入下一通道,与限制性内切酶消化(RD)试剂混合并到达第二个反应室。最后,限制性酶切产物进入电泳通道进行分离检测,通道内溶液流动通过外在压力控制。利用该芯片对流感病毒株(A/LA/1/87)的检测,不同病毒株的芯片电泳结果见图10-28。
图10-27 流感病毒检测用集成化微流控芯片示意图[30] 芯片包含有三个液体入口(L1.PCR试剂;L2.样品;L3 .RD试剂),多个混合液体用通道,PCR反应室,酶解(RD)反应室和电泳通道
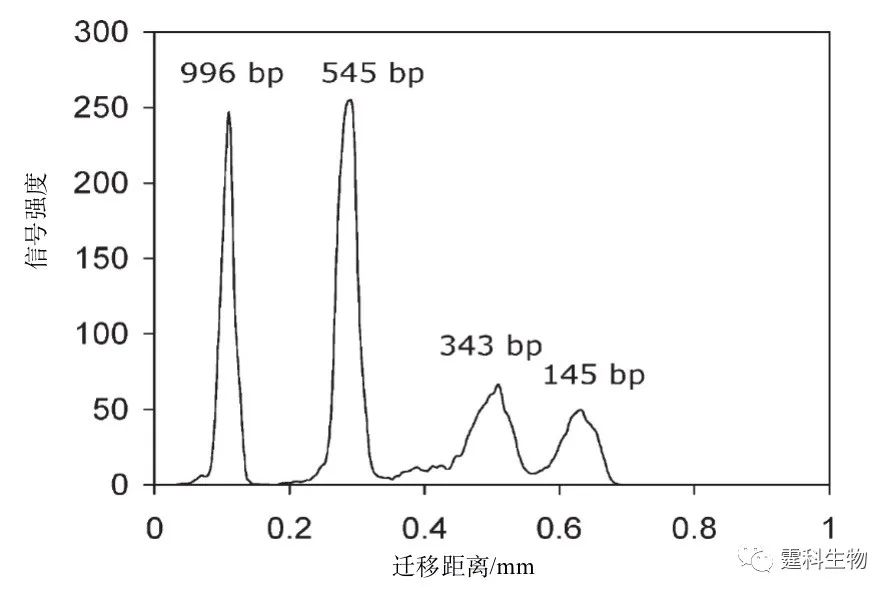
图10-28 流感病毒株(A/LA/1/87)DNA样品的微流控芯片检测结果[30] 片段145 bp和545 bp为HpaI限制性消化产物,343 bp和996 bp是内参Marker 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |