|
|
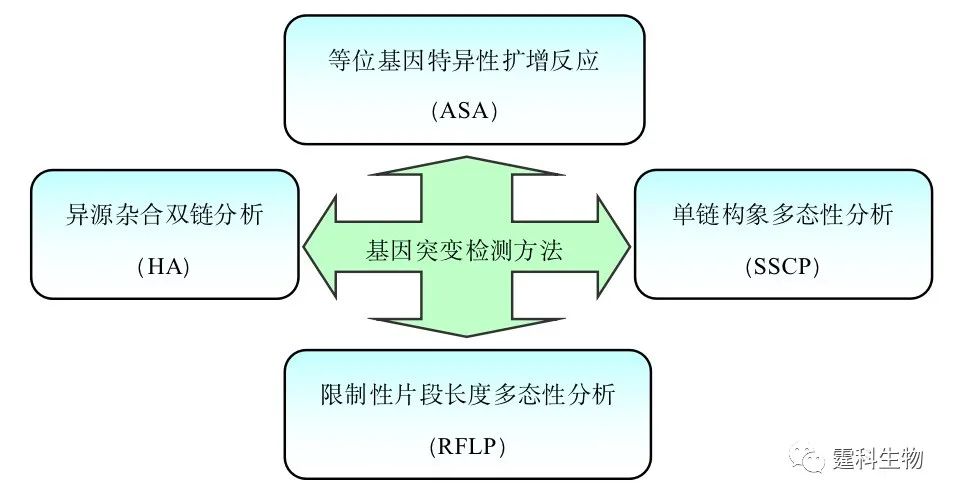
图解微流控|第29期发表时间:2022-01-04 14:53 微流控芯片实验室在核酸研究的应用(一) 核酸是以核苷酸为基本单位的重要生物分子,包括脱氧核糖核酸(DNA)和核糖核酸(RNA)两种。核酸是遗传信息的携带者,也是基因表达的物质基础。对核酸结构、功能与调控的认识是人类在分子水平研究遗传、进化和疾病诊断的基础。 核酸研究的技术如DNA萃取/纯化、PCR扩增、分子杂交、电泳分离和检测等都可以单一或集成地转移到微流控芯片上完成,因此微流控芯片技术显示了极强的核酸研究功能,适合于其所涉及的各个应用领域,如临床基因诊断、遗传学分析和法医学鉴定等。已有的工作所显示的微流控芯片的基本应用包括:基因突变检测、基因分型和DNA测序,而就对象而言,病原体的基因检测应用尤为广泛。此外,微流控芯片的集成化特点也使它成为DNA计算机发展的理想平台。本章将对上述内容一一予以阐述。 10.1基因突变检测 基因突变是指由DNA序列变异引起的基因结构的变化,包括点突变、基因重排和基因甲基化等类型。基因突变类型不同,其检测手段也有所差别。常见的基于PCR技术的检测方法如图10-1所示。微流控芯片的技术特征将使基因突变检测更趋于规模化和集成化。
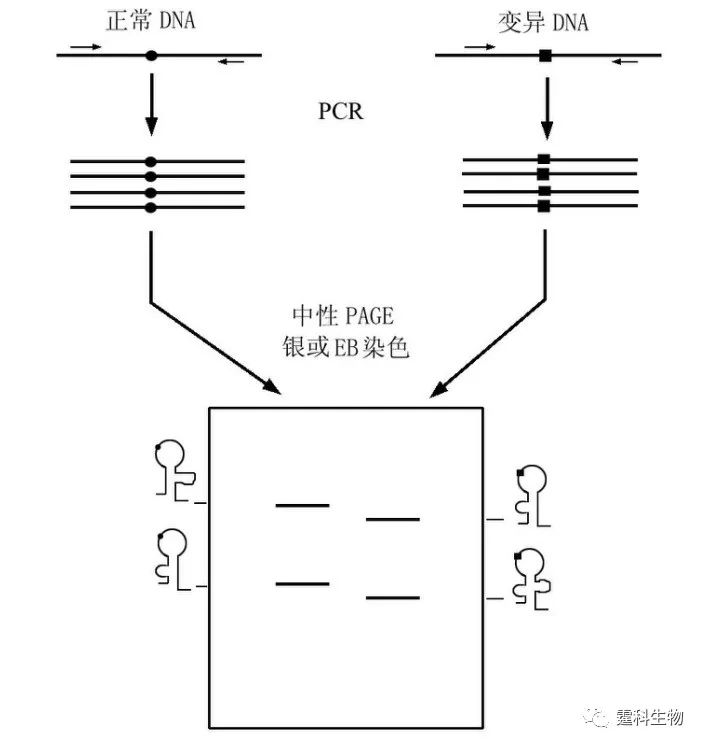
图10-1 常见的基于PCR技术的基因突变检测方法 10.1.1 点突变检测 点突变是指基因序列中单个碱基的变异,包括单碱基的替换、插入和缺失等,可引起相应蛋白质的一个氨基酸改变,继而改变蛋白质的空间构型和生物功能。 人类大部分的肿瘤几乎都存在相关基因的点突变。以乳腺癌为例,BRCA1和BRCA2是乳腺癌的易感基因,它们某些位点中存在点突变(如插入、缺失或替换突变),与乳腺癌的发病密切相关[1, 2]。 微流控芯片与多种基因突变检测方法结合,已用于BRCA1和BRCA2基因多种点突变的检测[3-5]。SSCP是用于已知点突变的常用检测方法,其原理如图10-2所示。
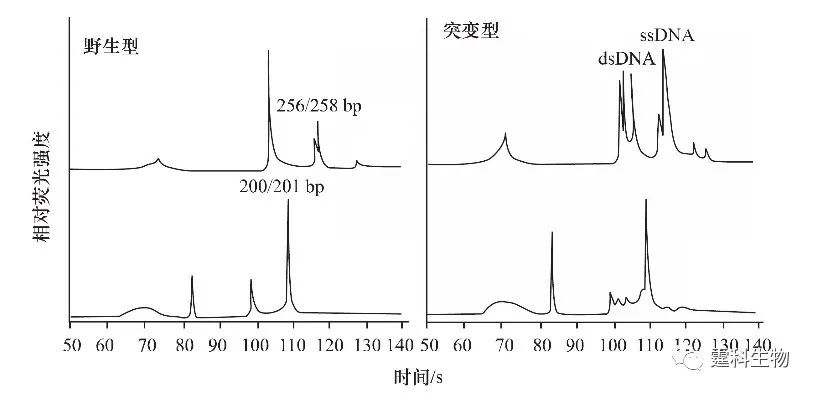
图10-2 SSCP检测突变原理示意图 单链DNA在中性条件下易形成二级结构,这种二级结构依赖于其碱基组成。正常DNA与变异DNA即使存在一个碱基的差别也会使单链DNA空间构象发生变化,并在非变性电泳条件下形成电泳淌度不同而得以鉴别 图10-3所示为在微流控芯片上以SSCP法对BRCA1基因两种点突变进行检测。目的基因的PCR扩增产物经变性后,单碱基差异引起单链DNA构象变化,使野生型和突变型等位基因的电泳谱图明显不同,如图中所示,上图为185delAG等位基因电泳图,下图为6174delT等位基因电泳图,野生型等位基因的电泳图在双链DNA区出现相对单一的单链ssDNA电泳峰(256/258 bp),突变型等位基因的电泳图则在相应位置出现至少三个电泳峰[3],提示有点突变存在。与毛细管电泳相比,芯片电泳方法所需检测时间明显缩短,仅用120 s。
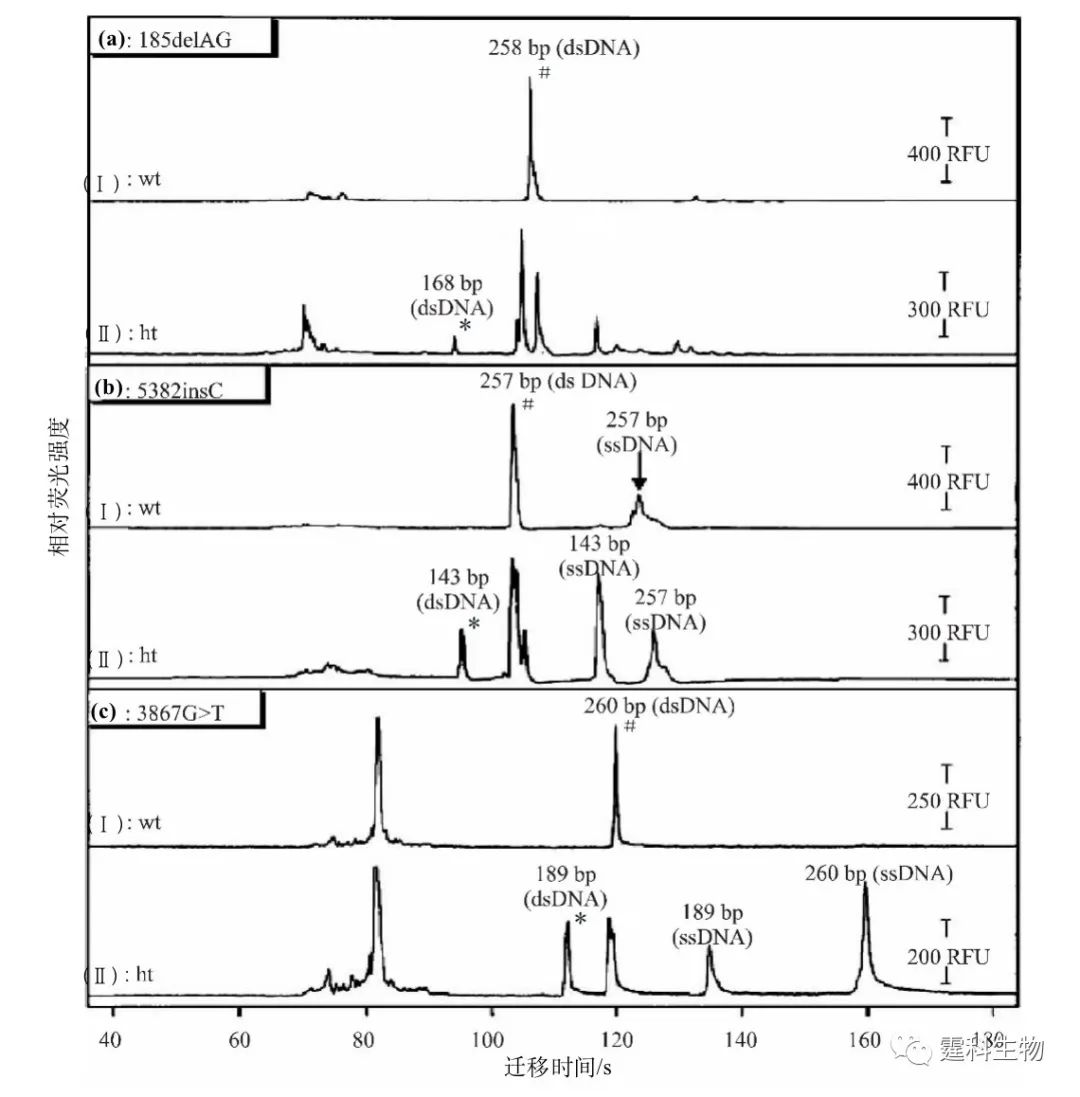
图10-3 微流控芯片和SSCP结合对BRCA1点突变检测结果[3] 两种点突变分别为185delAG(256/258 bp)和6174delT(201/200 bp) 图10-4所示为在微流控芯片上采用等位基因特异性扩增反应(ASA)和异源杂合双链分析(HA)法进行BRCA1基因突变检测[4]。运行时,先设计等位基因特异性引物,使其分别与野生型和突变型DNA序列互补,然后用PCR扩增出各自等位基因,再经异源杂合双链分析。由于异源双链DNA分子的同源性较差,因此构象与野生型DNA不同,可以通过电泳进行鉴别。如图10-4,野生型等位基因在DNA双链区只出现单一的电泳峰(# 标记,谱图Ⅰ、Ⅲ、Ⅴ),杂合型则出现至少三个电泳峰,并伴有一特征性的突变峰(* 标记,谱图Ⅱ、Ⅳ、Ⅵ)。据此,可识别该基因不同位点的三种杂合型突变(185 delAG、5382 insC和3867 TG),所需检测时间仅为毛细管电泳的1/10,显示验证了微流控芯片用于点突变检测的优越性。
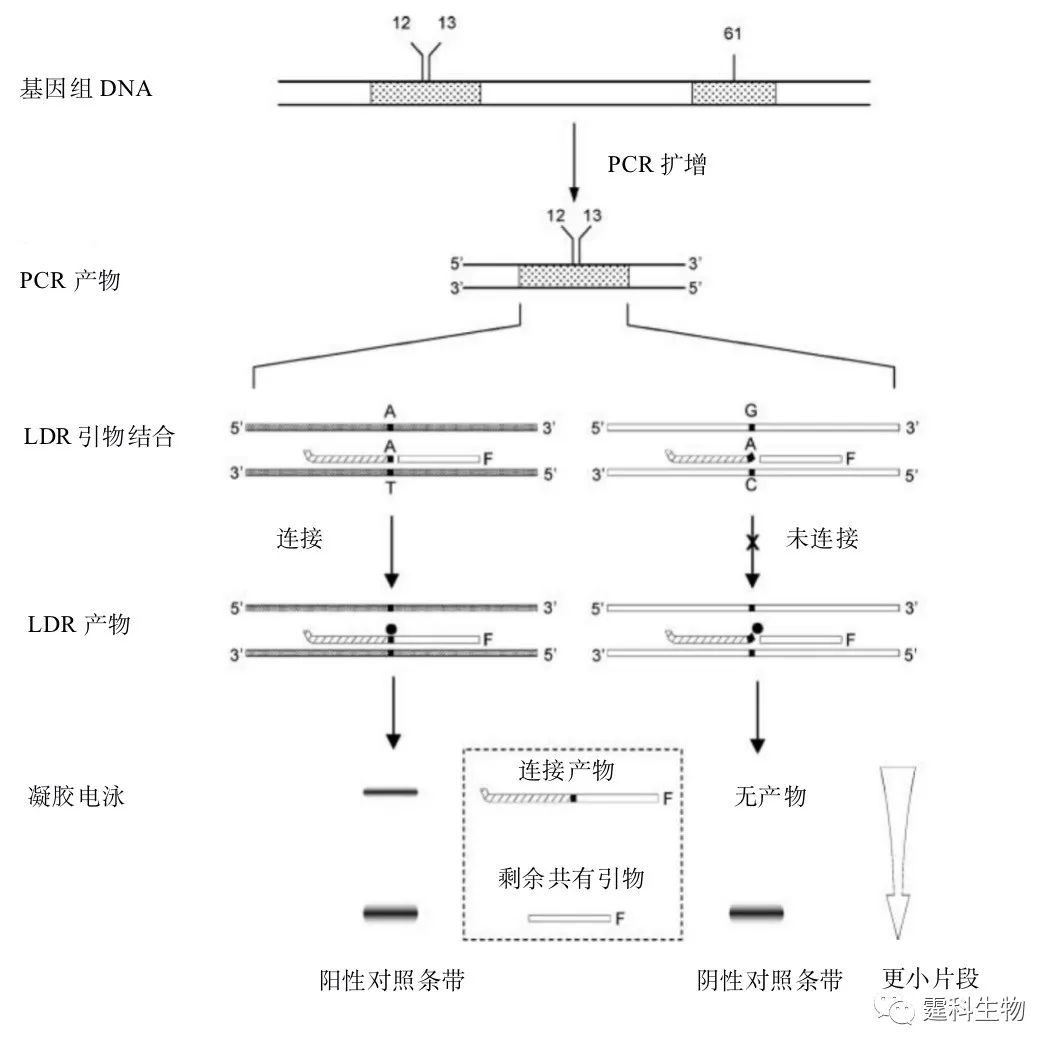
图10-4 ASA-HA联用微流控芯片BRCA1基因点突变检测结果[4] 图(a-c)中的两个电泳图分别特指野生型(Ⅰ)和杂合型(Ⅱ)突变 PCR与等位基因特异的连接检测反应(LDR)耦联是一种检测低丰度突变DNA的检测方法,利用微流控芯片所具有的功能单元规模集成的特性,将等位基因的PCR扩增过程与点突变检测集成在一块芯片上完成,可有效提高检测效率。其具体过程如图10-5中所示。
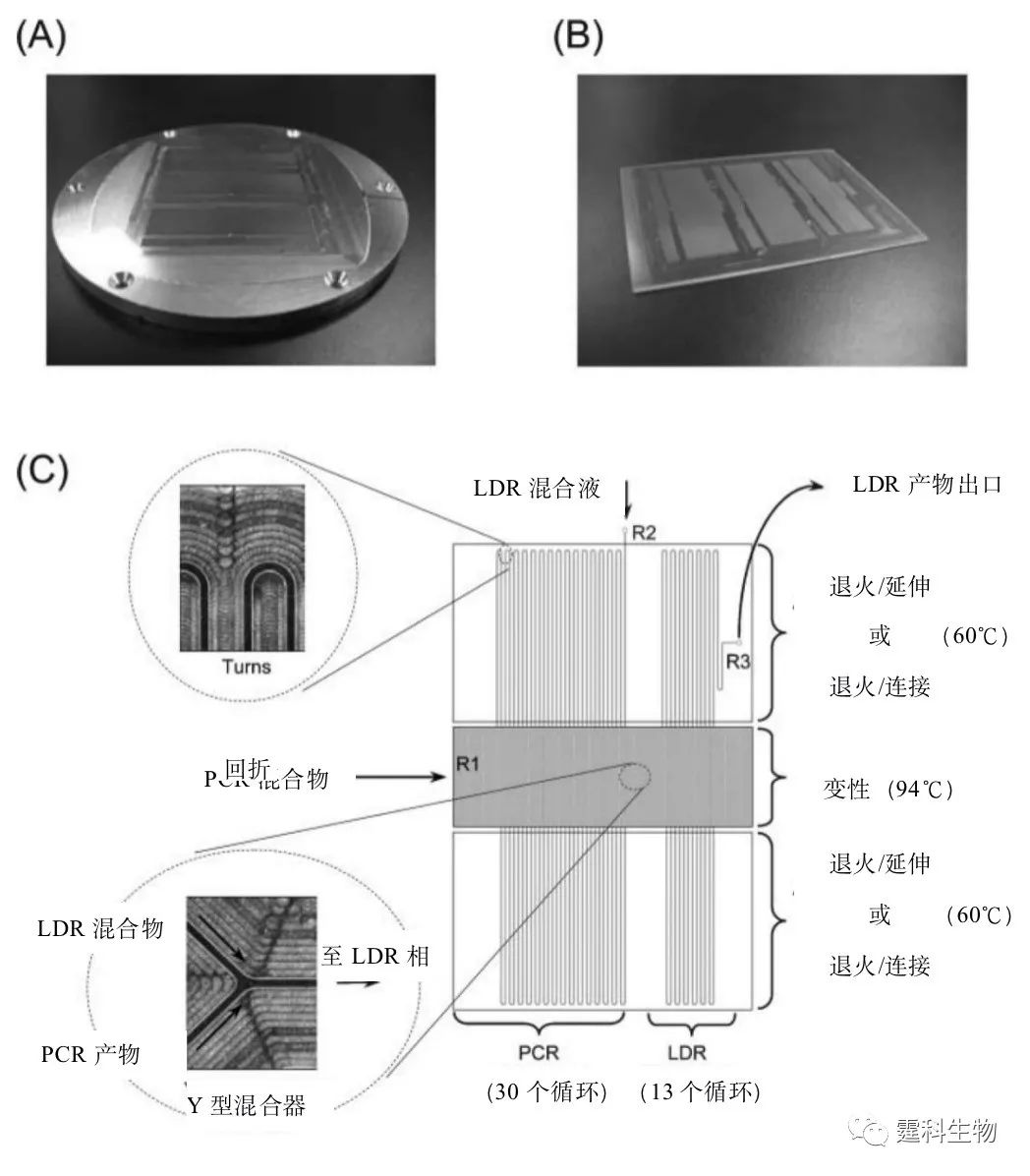
图10-5 PCR偶联的LDR过程的示意图 野生型和突变型的DNA链都含有单个碱基突变,DNA链经过PCR扩增后应用于LDR各个步骤。94℃时DNA链变性,60℃时两个LDR引物结合在互补链上,耐热性连接酶(·)只连接与目标序列精确互补的引物链,这样就会产生一个比起始引物长一些的寡核苷酸,电泳后即可通过产生的荧光信号确定发生点突变的序列(图10-5中条带图左半部分的条带)。在3’端至少有单个碱基对错配的引物将不会连接,在凝胶中不产生荧光信号(图10-5中条带图右半部分显示无条带)。 实例中流动式的微流控芯片,将初始的PCR反应和后续的LDR反应在芯片上集成,通过检测K-ras基因片段的单核苷酸多态性来检测基因组DNA中的低丰度点突变[6]。 LDR反应过程中用到的流动式PCR/LDR微流控芯片如图10-6(a)、(b)所示。微流控芯片的通道宽为50 μm、深为100 μm,通道间隔400 μm。热循环通道的全长为2.28 m,由30个循环的PCR(1.57 m长)和13个循环的LDR通道(0.71 m长)构成。这个集成的微流控系统可以在1000个正常序列中检测出一个突变DNA序列。检测速度相对快捷而且在多元模式下可以同时筛选多个突变。
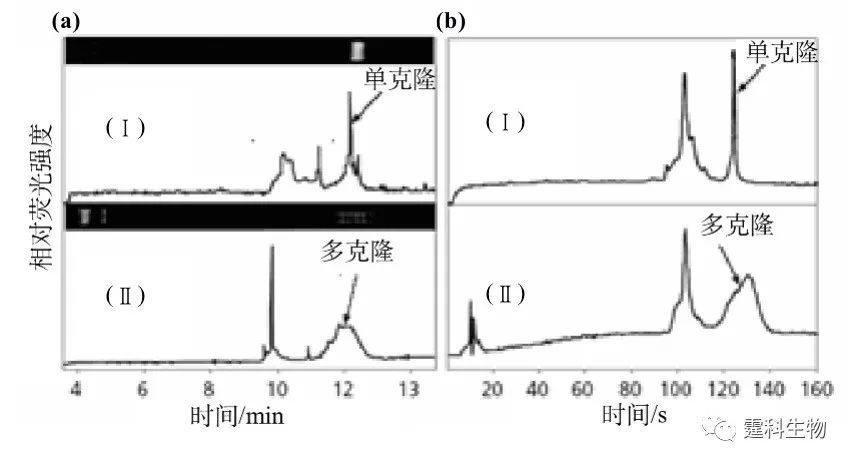
图10-6 流动式PCR/LDR微流控芯片的实物图和示意图 (a) 铜制模具;(b) 聚碳酸酯微流控芯片实物图;(c) 微流控芯片的通道设计示意图,放大部分别是流动式热循环通道的弯折处和Y形被动微混合器的放大示意图,微混合器将PCR产物与LDR混合液混合起来,在芯片的特定的位置有三种不同的Kapton膜加热器提供所需要的等温区域 10.1.2 基因重排检测 基因重排是指DNA的断裂错接而使正常基因顺序发生改变的一种现象。基因重排是基因突变的一种形式。 基因重排易使癌基因被激活,或使抑癌基因失活,从而导致细胞癌变。T细胞受体(TCR)基因和免疫球蛋白(IgH)基因是T、B恶性淋巴瘤的高表达基因,TCR和IgH基因重排是诊断T、B恶性淋巴瘤的重要依据[7]。 通过多重PCR扩增,并结合微流控芯片电泳,可对恶性淋巴瘤实现快速诊断。B细胞淋巴瘤阳性样品的芯片PCR扩增电泳检测结果如图10-7所示。实验中选择多对引物对TCR可变区和IgH结合区进行PCR扩增,以YO-PRO-1荧光探针标记dsDNA片段,然后进行芯片电泳-激光诱导荧光检测。由于正常细胞来自多克隆细胞,PCR扩增后芯片电泳可呈现多个产物峰。而淋巴瘤细胞则来源于单克隆,即单一的IgH或TCR基因重排方式,因此,PCR扩增产物只出现单一的电泳峰,据此,可判定是否存在基因重排。图中可见,芯片电泳检测时间仅相当于毛细管电泳的1/10。
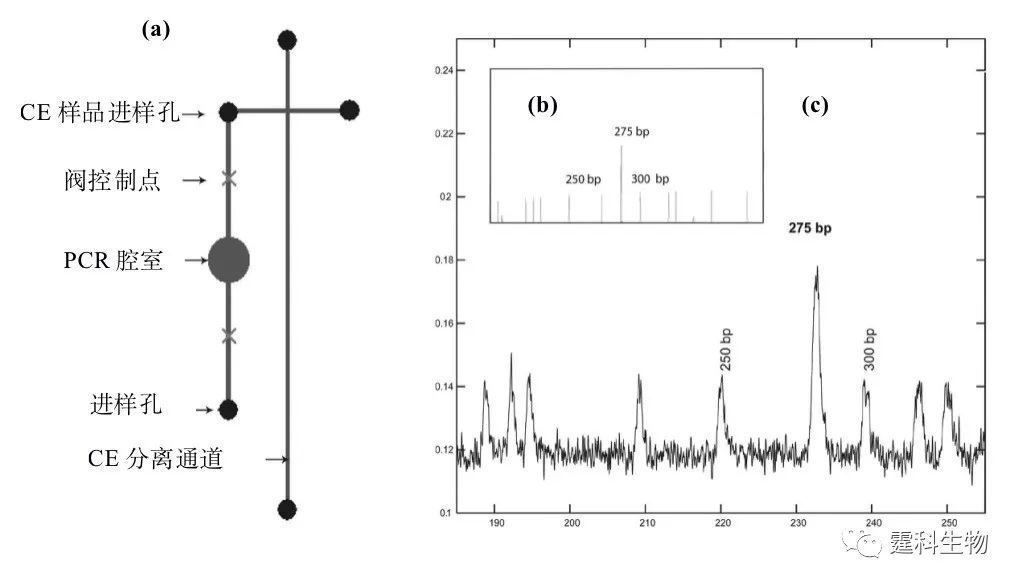
图10-7 IgH基因重排检测结果(a)毛细管电泳和(b)芯片电泳[9] (a-b)图中(Ⅰ)B细胞淋巴瘤阳性样品,(Ⅱ)阴性样品 图10-8所示为利用集成RT-PCR和芯片电泳的微流控芯片,通过诊断IgH基因重排和染色体易位明确鉴定恶性细胞的多发性骨髓瘤的特性[8]。微流控芯片提供了一种快速、敏感和低成本的肿瘤诊断方法。
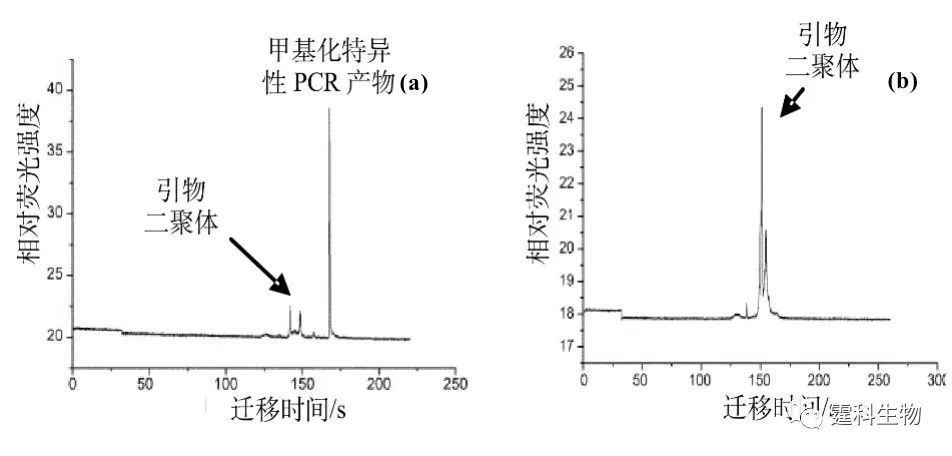
图10-8 检测基因重排的集成的RT-PCR-CE芯片设计图 骨髓瘤患者的骨髓细胞RNA经过纯化后与特定试剂混合被注入微流控芯片(a),预期的产物通过ABI3100系统确认(b),经过反转录、PCR扩增和CE,最终得到275 bp大小的产物(c) 10.1.3 基因甲基化检测 在甲基转移酶的作用下将一个甲基基团加到DNA分子核苷酸碱基上的生化过程,被称之为基因的甲基化,也是基因突变的一种形式。 基因甲基化是基因正常的修饰形式,但是异常基因甲基化则是基因失活的一种重要机制,对肿瘤的发生及其发展有重要影响。 利用微流控芯片电泳可对甲基化样品进行分析。微流控芯片电泳在诊断敏感性和特异性方面保持了现行凝胶电泳的水平,由于采用激光诱导荧光检测,其检测灵敏度和检出率均较现行方法要高。 抑癌基因p16的启动子区CpG岛甲基化存在于多种肿瘤,被认为与肿瘤发生有关[10]。作者所在课题组利用微流控芯片系统,并结合巢式PCR方法,对大量临床肿瘤样品的p16基因甲基化进行了检测,并与现行凝胶电泳方法进行比较[11]。图10-9为p16基因甲基化阳性样品的微流控芯片电泳图谱,图中150 bp为特异性扩增产物。
图10-9 p16基因启动子甲基化诊断芯片电泳图(a)阳性和(b)阴性样品[11] (阳性样品具有甲基化特异性PCR产物,而阴性样品没有产物) 电泳条件:筛分介质1.5% HPMC-50 + 89 mM TBE缓冲液 (pH 8.3),进样时间30 s,分离电场210 V/cm,有效分离距离3 cm,荧光探针Sytox Orange 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |