|
|
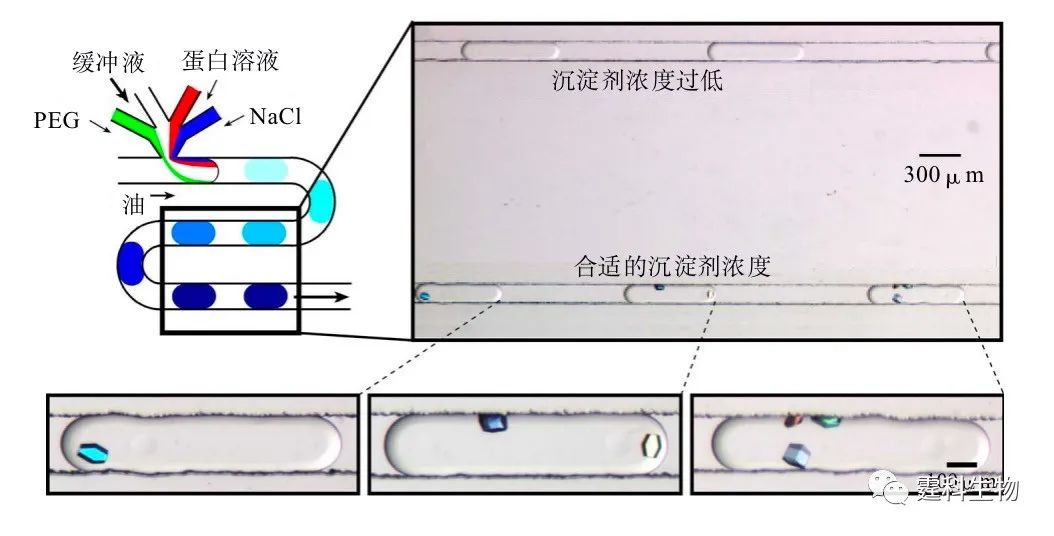
图解微流控|第24期发表时间:2021-12-07 14:47 液滴技术(三) 8.6 液滴的应用示例 随着液滴操控技术的发展成熟,对液滴的研究逐步转向应用,比较成功的例子包括蛋白结晶、酶分析、细胞分析、材料制备和复杂过程模拟等,下面分别进行介绍。 8.6.1 蛋白质结晶研究 了解蛋白分子的三维结构不仅具有理论意义,还可用于指导药物分子的设计,对新药研制具有重要意义。当前,X射线晶体衍射是最主要的蛋白质分子三维结构解析手段,如何获得高质量的蛋白质晶体一直是困扰科研工作者的难题,也是蛋白质三维结构解析的瓶颈。传统的蛋白质结晶过程主要在微孔板上进行,依赖手动操作,将蛋白质溶液与不同种类和浓度的沉淀剂混合,筛选出最佳结晶条件并用于晶体的生长。该法最大的缺点是蛋白质消耗量大而且操作繁琐。如前文所述,微液滴的一个突出优点是体积小,以液滴为平台结晶蛋白质,将极大减少蛋白质消耗量,同时有望实现自动化操作,见图8-23。
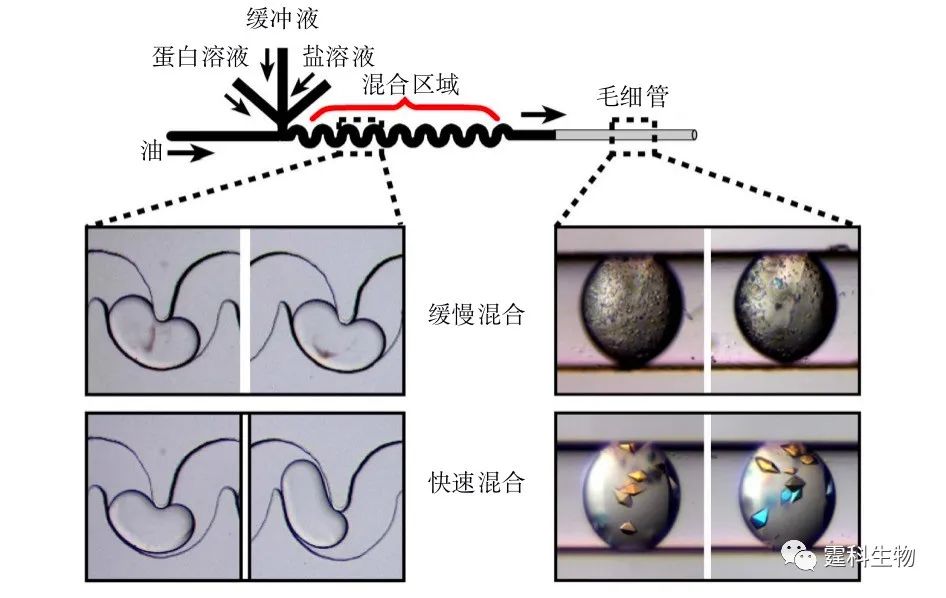
图8-23 液滴用于蛋白质结晶[16] 由于液滴内的混合过程基于混沌对流,混合速度可方便地由液体的流速调节,因此有可能研究蛋白质溶液和沉淀剂的混合速率对蛋白晶体生长的影响。结果发现,混合速度比较小时,液滴内易形成许多蛋白质微晶,增大混合速度则可明显减少蛋白质微晶的数量并增大单个蛋白质晶体的尺寸,如图8-24所示。
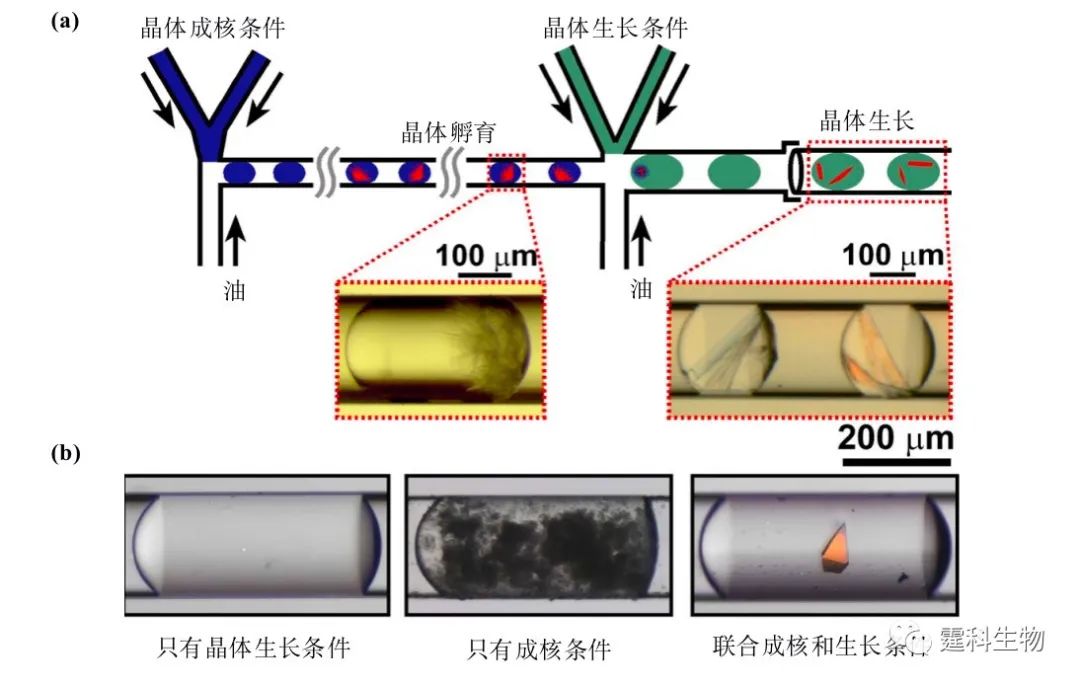
图8-24 混合速度对蛋白质结晶的影响[17] 根据晶体生长理论,蛋白质结晶过程分为两个阶段:成核和生长,每个阶段的最佳条件不同,如沉淀剂的种类和浓度等。由于液滴特有的操作灵活和快速混合等特点,可以将上述两个过程分开,提高蛋白质结晶质量,见图8-25。
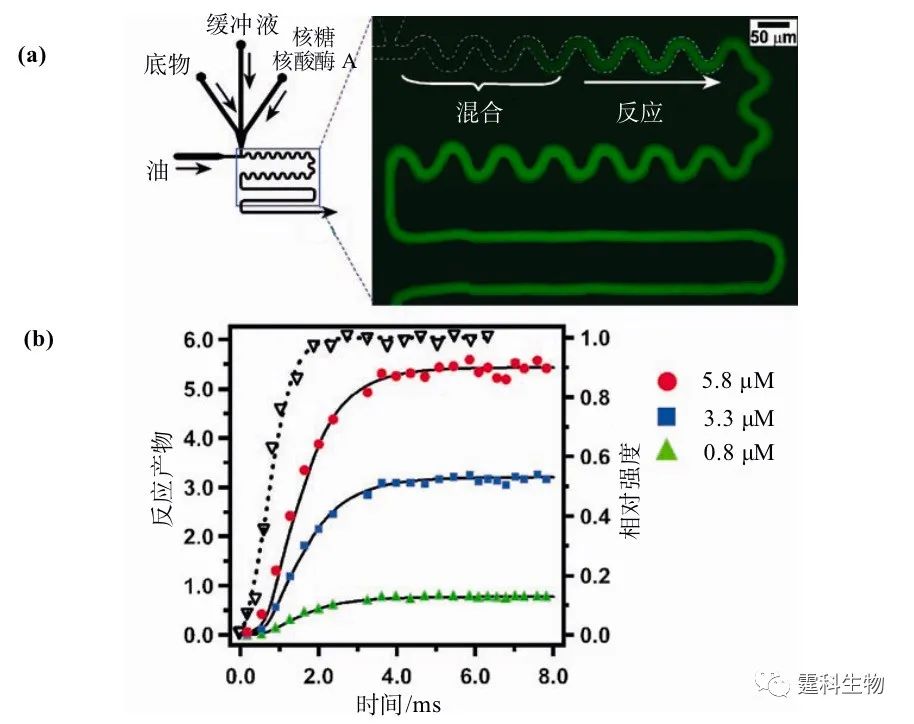
图8-25 成核和生长分离对蛋白质结晶的影响[18] (a) 操作示意图,虚线内是不同阶段蛋白晶体的生长状态;(b)不同条件对蛋白结晶的影响 8.6.2 酶反应 液滴体积小、混合迅速、反应条件稳定,是一种理想的反应平台。将液滴用于酶反应分析,不仅可以大大降低样品消耗量,节约成本,还能在毫秒水平上对酶的反应动力学进行研究。在图8-26中,核糖核酸酶A和底物溶液被缓冲液分隔,避免液滴形成之前两者的混合,在T通道连接处被载流包裹形成包含酶、缓冲液和底物的液滴。液滴流经蛇形通道时,在混沌对流的作用下,内部的酶和底物在毫秒水平即可充分混合、反应并释放荧光基团。
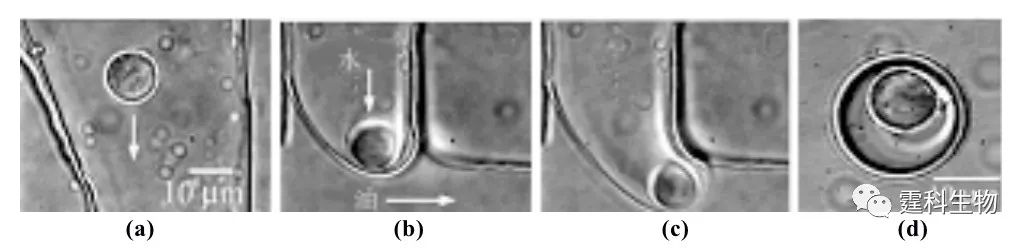
图8-26 核酸酶A的反应动力学研究[4] (a) 装置示意图和处于运动状态的液滴的时间平均荧光强度图(曝光时间:2 s);(b) 三种不同浓度底物下,液滴内核酸酶A反应产物随时间的荧光强度变化(实线),对比实验Fluo-4/Ca2+(虚线)的荧光曲线说明液滴内反应物在2 ms内充分混合 8.6.3 细胞和模式生物研究 液滴和细胞的尺寸相近,操作灵活,使其迅速成为微流控芯片细胞研究的一种新的技术手段。根据操作过程不同,液滴用于细胞研究分为两种情况:直接将细胞包入液滴和分步包裹细胞。 图8-27介绍了以光学方法捕获单个细胞并将其包入液滴的方法。首先利用光钳将单个细胞移动到油水两相界面处,然后缓慢增加水相的压力,形成包含单个细胞的液滴,再进行后续的单细胞分析。
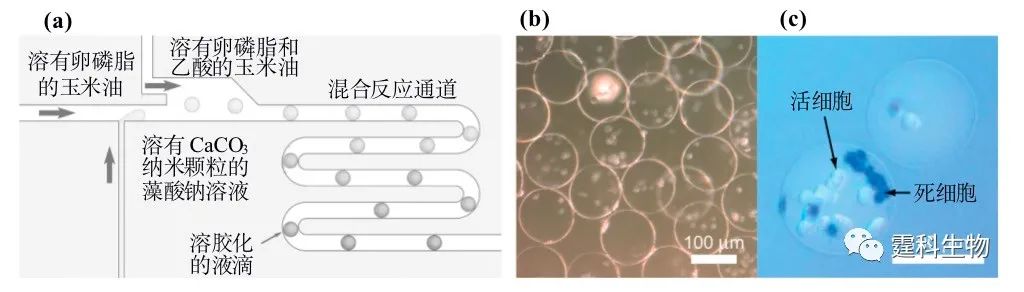
图8-27 液滴包裹单个细胞[19] (a-c) 细胞包入液滴过程;(d) 包含单个细胞的液滴 在另一种方法中,先将细胞分散在生物相容性较好的功能材料溶液中,形成包含细胞的液滴后再使材料固化形成包有细胞的固体微球,如图8-28(a)所示,首先将细胞悬液加入到含有CaCO3纳米颗粒的海藻酸钠溶液中作为水相,形成液滴后,在通道下游通过侧路加入含醋酸的油相,使得液滴外周油相的pH值减小,液滴内部的CaCO3纳米颗粒水解释放Ca2+,液滴内的海藻酸钠与Ca2+反应,凝胶化形成包有细胞的微球,见图8-28(b)、(c)。
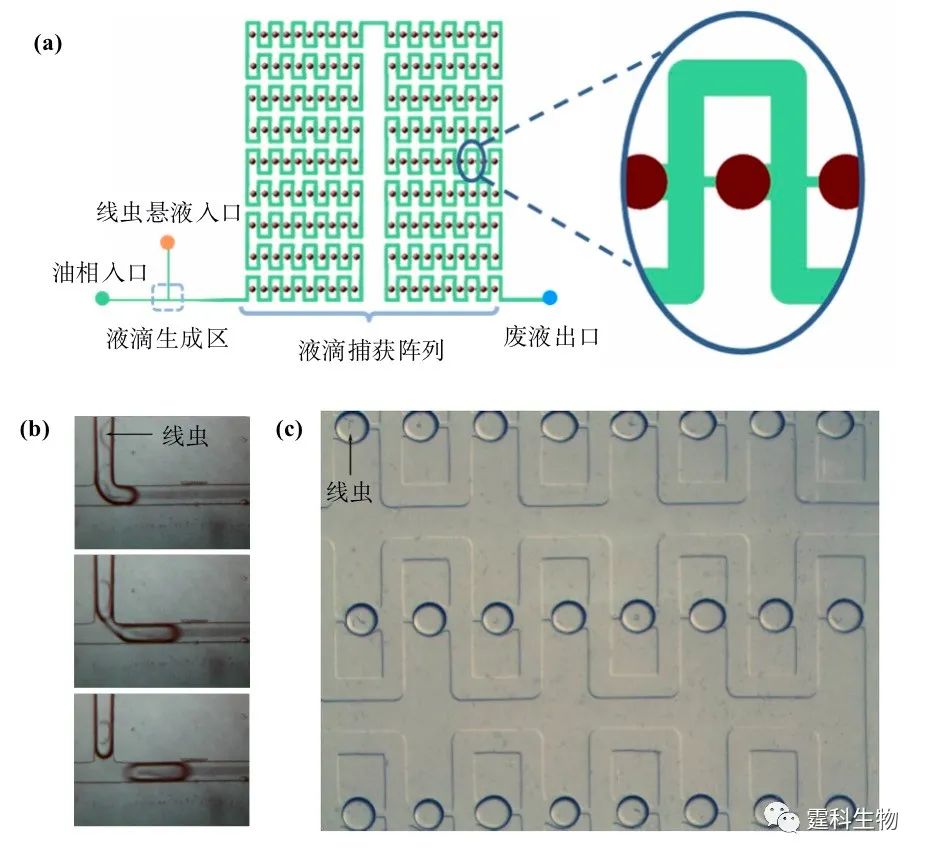
图8-28 海藻酸钠微球包裹细胞[20] (a) 芯片示意图;(b) 包有细胞的海藻酸钠微球;(c) 染色后的微球,死细胞呈兰色,活细胞透明无色 尽管现在已经有很多工作研究利用液滴进行生物学研究,然而他们都还没有涉及到对复杂生物体(如模式生物线虫)的研究。液滴特有的微尺寸特征与线虫大小相匹配,加之芯片灵活设计和规模集成特征,非常适合以线虫为对象进行高通量个体生物学研究,作者实验室在这方面作了一些有益的探索。 秀丽隐杆线虫(caenorhabditis elegans)是一种经典的模式生物,广泛用于发育、遗传学、神经生物学和药学等领域研究。线虫的许多疾病表型能忠实再现人类疾病过程,这些独特特征使线虫成为研究人类疾病的最佳模式生物体之一。据此,作者实验室采用微流控芯片产生包含单个线虫的纳升级液滴并利用微结构使之固定,然后在线观察单个线虫的行为。图8-29(a)为芯片示意图,图的右侧为液滴捕获结构的放大图,8-29(b)为液滴包裹线虫过程,8-29(c)为包裹有线虫的液滴阵列。
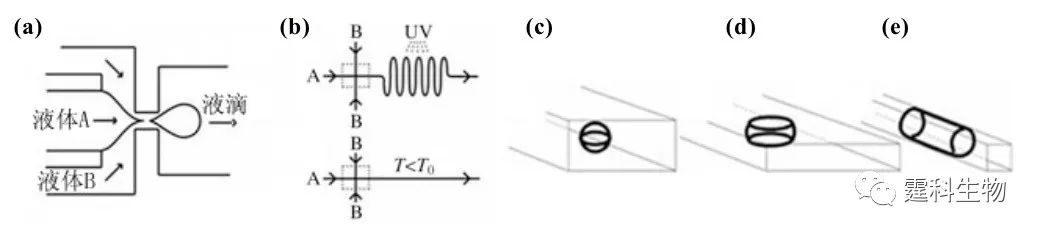
图8-29 液滴包裹线虫[21] (a) 芯片示意图;(b) 液滴包裹线虫过程;(c) 包裹线虫的液滴阵列 8.6.4 微颗粒材料制备 形貌均匀的微颗粒材料在药物运输、光电器件以及催化等领域都有重要应用。液滴独特的性质使其在微颗粒材料合成领域有着巨大的潜力,如形状可控、大小均匀、适用材料种类多样等。图8-30介绍了利用液滴合成形貌可控的微颗粒材料的原理。通常情况下,液滴在表面张力的作用下呈球状,当液滴的半径大于微通道某一个方向的尺寸时,由于通道壁的限制,被迫改变形状,形成非球状的形貌,如图8-30 (d-e)所示。当含有一定体积聚合物单体的液滴流经不同形状的微通道时,在线进行紫外光照射(或热诱导)凝胶化和液-固相变,可得到不同形貌的聚合物或金属微颗粒,如图8-31所示。图8-32为作者实验室利用液滴制备的PEG凝胶微颗粒。
图8-30 微颗粒合成和形貌控制原理[22] (a) 液滴产生单元;(b) 紫外光聚合微颗粒芯片;(c) 热固化微颗粒芯片;(d-e) 不同形状通道内液滴的形貌
图8-31 不同形貌的微颗粒[22] (a-e) 为TPGDA聚合物颗粒:(a) 微球,(b) 微球晶体,(c) 微棒,(d) 圆盘,(e) 椭球;(f) 琼脂糖圆盘颗粒;(g) 铋合金椭球颗粒
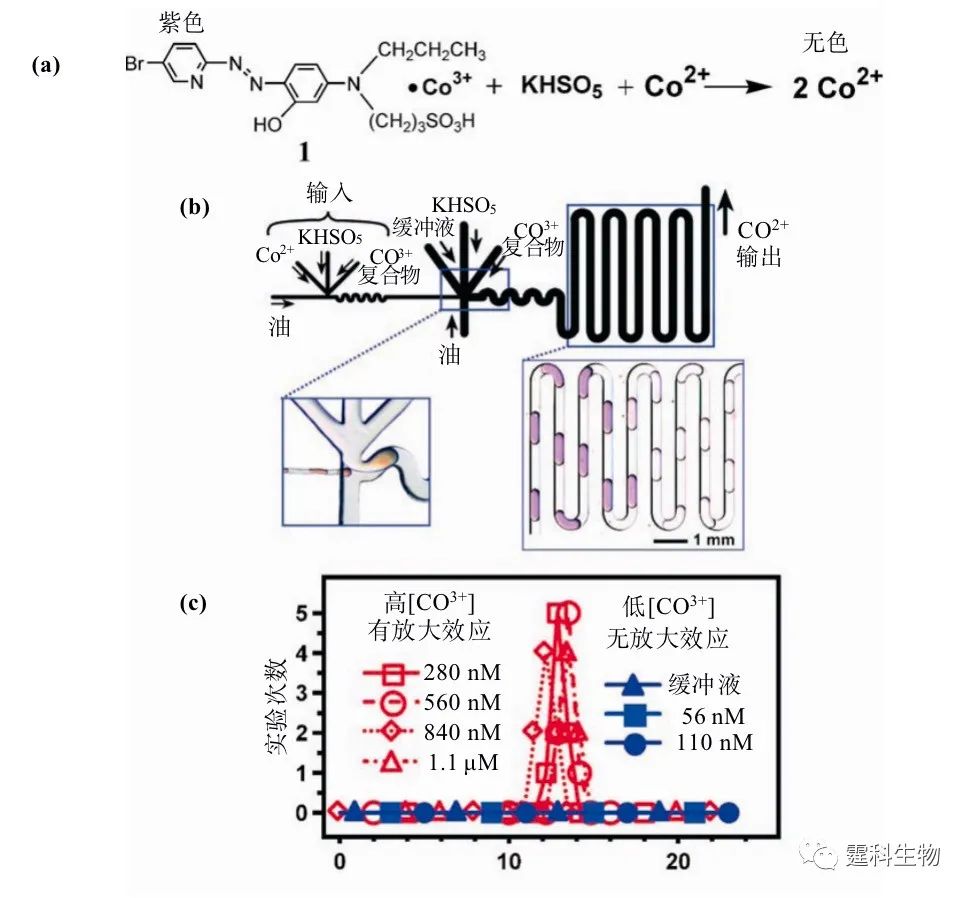
图8-32 PEG凝胶微颗粒 8.6.5 复杂过程的模拟 在生物学中,许多的生物功能都是由相互作用的酶反应网络完成的,如自调节、能量转换等。上述功能化的反应网络通常远离平衡状态,难以用普通方法模拟和研究。微流控液滴技术可以灵活方便地控制反应并将反应产物带走,为研究复杂的反应网络提供了一种途径。 图8-33中以微流控芯片液滴为平台,以自催化反应为模型,模拟了信号传导中的放大过程,通过对反应条件的设定,实现了信号放大过程中的阈值行为。 上述反应中,紫色的Co3+复合物与KHSO3在Co2+的催化下,生成无色的Co2+,是一个自催化反应,反应机理见图8-33(a)。为模拟信号传导过程中的阈值现象,反应分两步进行,见图8-33(b)。第一步中,一定浓度的Co3+复合物、KHSO3和Co2+同时包进液滴、混合反应,由于该反应是一个自催化反应,绝大部分Co3+在反应的最后阶段转化为Co2+。接下来向液滴中加入新鲜的Co3+复合物和KHSO3溶液,Co2+被稀释,开始第二步反应。由于该反应的自催化特性,只有当初始的Co2+浓度达到一定水平时,才能在第一步反应结束时生成足够的Co2+,并在第二步反应中催化Co3+转化为Co2+,使液滴的颜色在规定的时间内由紫色变为无色,见图8-33(b)。图8-33(c)是不同初始浓度的Co2+反应结果的比较,表现出明显的阈值特征。
图8-33 基于液滴的信号放大反应网络[23] (a) 反应机理;(b) 芯片示意图,反应分两步进行;(c) 只有当Co2+初始浓度达到一定值时,才出现放大现象(液滴由紫色变为无色),低于该值则无颜色变化 8.6.6 液滴在信号编码中的应用 微流控系统中,通道特征尺寸在微米级,流体的流速通常较低,表征流体流动状态的雷诺数Re远小于2000,流体处于层流流动状态。此时,通过对流体施加方向相反的作用力,流体的行为在一定范围内可以逆转,使系统回到初始运动状态。依据上述原理,哈佛大学的研究人员创造性的将微流控芯片液滴系统用于信号编码的研究。 信号编码涉及信号输入和信号输出两个方面。图8-34介绍了微流控芯片液滴系统如何将输入信号转变为输出信号的。图8-34(a)是芯片示意图,主要包括两个部分,液滴形成单元和编码单元,其中编码单元是一个上、下不对称的环结构,如图8-34(b)所示。当一个液滴运动至靠近编码单元时,由于环结构的上、下部分长度不同,流体流动阻力不同,液滴将进入流阻相对较小的半环;由于液滴的存在,将增大其所在半环的流动阻力,进而影响下一个液滴的运动路径。结果,液滴进入编码单元之前是等距的,从编码单元流出时相邻液滴之间的间距发生改变,将液滴的间距用时间间隔来表示即可从一组输入信号得到另一组输出信号,如图8-34(c)所示。改变输入液滴的时间间隔,将得到一系列具有规则或不规则间隔的输出信号,如图8-35所示。图中用相邻液滴的时间间隔之比作图,得到Poincare图,图中所有时间间隔为与初始时间间隔的相对值。
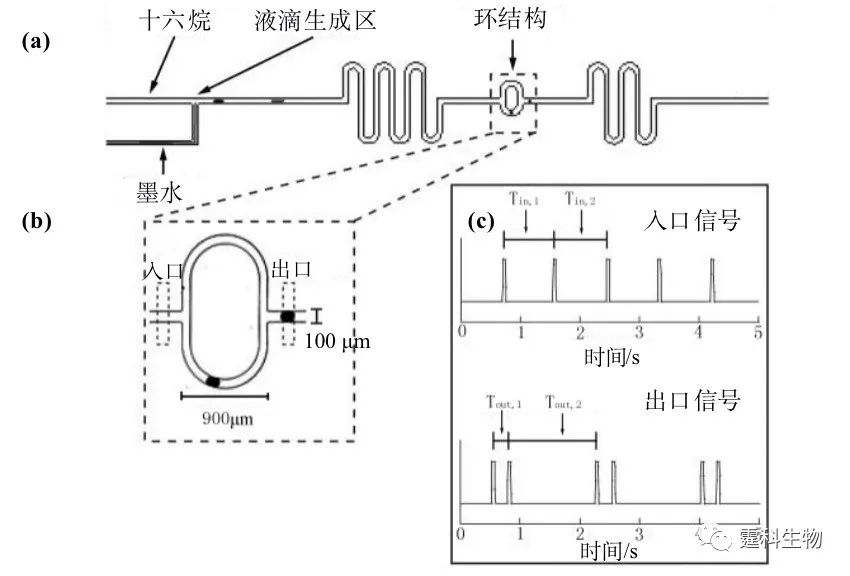
图8-34 微流控芯片液滴用于信息编码[24] (a) 芯片示意图;(b) 编码单元放大图;(c) 输入信号到输出信号的转换
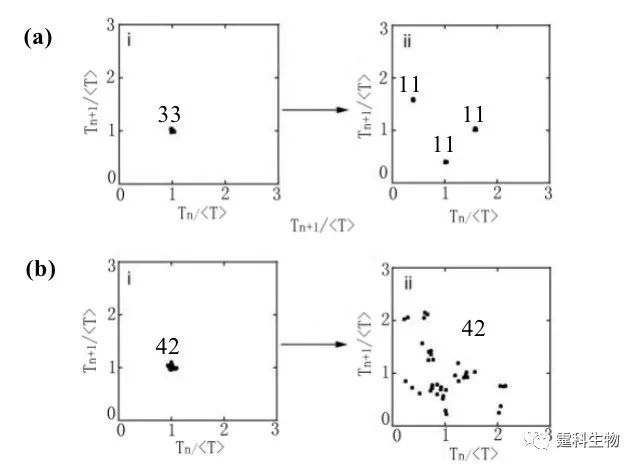
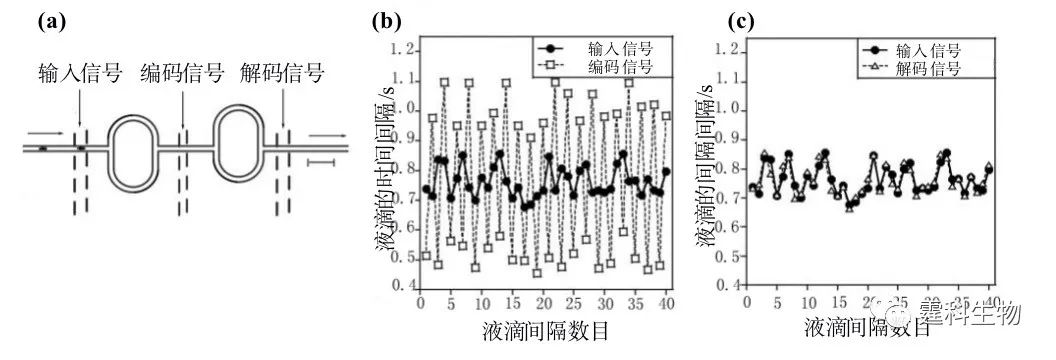
图8-35 规则和不规则的输出信号[24] (a) 三周期模式;(b) 无规则模式,i为进入编码单元前的时间间隔,ii为从编码单元出来后的时间间隔,图中数字表示该种时间间隔的液滴数目 完整的信息传递过程还包括信息的读取,即解码。如前文所述,通过对流体施加方向相反的作用力,流体的行为可以逆转,使系统回到初始状态,过程见图8-36(a)。当一串液滴经过编码单元后,施加一个相反方向的力,使其运动方向逆转,记录下液滴回到编码单元左侧时相邻液滴的时间间隔,结果发现,在误差范围内,相邻液滴的时间间隔与初始情况相同,这样就实现了解码过程,见图8-36(b)。图8-37介绍了一个完整的信号编码-解码过程。图8-37(a)为芯片示意图,芯片包含两个环状结构,左边的为编码单元,右边的为解码单元,两者大小相同,沿通道上下对称排列。一串液滴流过左边的编码单元后被编码,液滴流过解码单元后重现初始运动状态被解码,如此便实现了信号的输入-编码-输出过程。8-37(b)和(c)分别为输入信号和编码信号的对比图以及输入信号和输出信号的对比图。
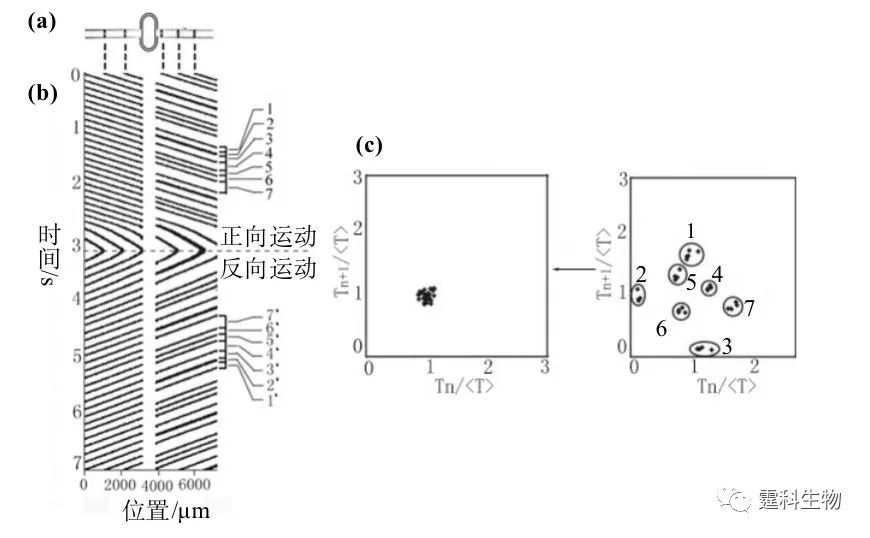
图8-36 基于微流控芯片液滴的信号解码[24] (a) 液滴流经编码单元的示意图;(b) 液滴的运动轨迹随时间的变化情况,图中每条斜线代表一个液滴的运动轨迹;(c) 液滴逆向流过编码单元后相邻液滴的时间间隔
图8-37 基于微流控芯片液滴的信号编码-解码过程[24] (a) 芯片示意图;(b) 输入信号与编码信号的对比图;(c) 输出信号与输入信号的对比图 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |