|
|
前沿资讯 | 一种基于比色法全流程检测鉴定病毒病原体的离心式微流控系统发表时间:2024-01-29 13:50 大家好!今天为大家分享一篇2024年一月发表在Lab on a Chip上的文章,题目为“Centrifugal microfluidic system for colorimetric sample-to-answer detection of viral pathogens”。加拿大国家研究委员会生命科学部的Matthias Geissler团队提出了一个全自动Sample-To-Answer的病毒病原体比色检测系统,采用卡盒式微流控芯片结构结合离心和气动驱动,可实现病毒裂解、PCR 扩增、杂交、缓冲液和试剂检测全流程。本文的通讯作者为加拿大国家研究委员会生命科学部的Matthias Geissler。 研究背景 迄今为止,由食源性病毒,如诺如病毒(NoVs)和甲型肝炎病毒(HAV)等,造成和散发的大流行性疫情仍然会对发展中国家和工业化国家公共卫生机构造成沉重负担。这些病毒通常具有易感染、易传播、在食物和环境中保存时间长等特点。其中NoVs 是一种单链 RNA 病毒,属于杯状病毒科,该病毒分为 10 个基因组 (GI-GX),GI和GII是NoVs暴发的主要基因型。在摄入受污染的食物或与感染者接触后 12 至 48 小时内出现症状,包括呕吐、腹泻、痉挛和腹痛等。根据世界卫生组织(WHO)的数据,全球每年估计有6.85亿例NoVs感染,导致约20万人死亡。根本原因在于缺乏常规和强大的 NoVs 细胞培养系统,如鼠诺如病毒 (MNV) 和猫杯状病毒 (FCV)。此外, HAV是单链RNA病毒,可引起肝炎-肝脏炎症,感染后2周至6个月内出现发烧、疲劳、恶心和腹痛等症状。世界卫生组织估计,2019年全球有1.59亿人感染HAV,导致3.9万人死亡,大多数感染发生在卫生条件不足的低收入和中等收入国家。及时有效地发现食源性病毒,可以及时进行干预,从而控制病毒的进一步传播,保护个人和社区免受潜在疫情的影响。及早发现食源性病毒可以让卫生机构能够采取适当的对策,包括召回受污染的食品、发布公共卫生警报和咨询、调查病毒来源以及执行环境卫生和个人卫生措施以防止进一步传播。检测病毒病原体的标准方法是逆转录聚合酶链反应 (RT-PCR) 与分子测定相结合,可实时进行灵敏的定量确认。然而传统的RT-PCR检测方法存在局限:例如复杂的核酸提取物样品制备过程无法覆盖到食品制造的各个环节;大部分发展或落后地区的分析能力有限,且该分析具有一定时效性,难以普及到各大疫情高发的使用场景。 微流控技术通过将样品制备和分析过程集成到紧凑的、基于芯片的形式中,为传统实验室技术提供了一种令人信服的替代方案,对流体操作步骤的控制水平有助于开发小型化、从样品到结果的平台,从而提高灵敏度,同时减少样品和试剂消耗,以及手动操作和相关的错误或污染风险。此外,微流控集成促进了可移植性和自动化,这是常规监测和现场部署的先决条件。基于此,来自加拿大国家研究委员会生命科学部的Matthias Geissler团队提出了一个全自动Sample-To-Answer的病毒病原体比色检测系统,采用卡盒式微流控芯片结构结合离心和气动驱动,可实现病毒裂解、PCR 扩增、杂交、缓冲液和试剂检测全流程。使用靶标特异性寡核苷酸捕获探针在嵌入式微柱阵列上进行杂交,使用多重 PCR扩增与DIG标记物偶联的五种病毒病原体(FCV、HAV、MNV、NoV GI 和 NoV GII)的 RNA 标记基因。通过离心平台和可编程泵送和压力控制系统,用于调解滤芯上的流体位移。并利用集成到旋转平台中的热电模块实现可编程的片上加热和冷却。通过频闪成像系统,用于实时可视化和记录片上过程。整个过程高度集成,离心和气动驱动步骤序列进行,从而实现分析自动化。 图文导读 芯片设计及制备:微流控芯片(图1b-e和2a)由透明的热塑性聚合物制成,其形式为具有矩形几何形状的混合三层堆叠。顶部和底部由硬质热塑性聚合物(分别为PC和Zeonor)组成,以提供机械稳定性,而包含流体回路的中心部分则由热塑性弹性体(TPE)制成。使用热压成型或注塑成型等热成型技术的可能性使 TPE 适用于微流控器件的原型制作和大规模制造。TPE 的另一个优点是它能够贴合并提供与另一个表面的紧密接触,从而实现微流体导管的有效密封。硬质和软质热塑性聚合物之间的接触力能够使用压力驱动的流动对流体进行安全、防漏的操作。 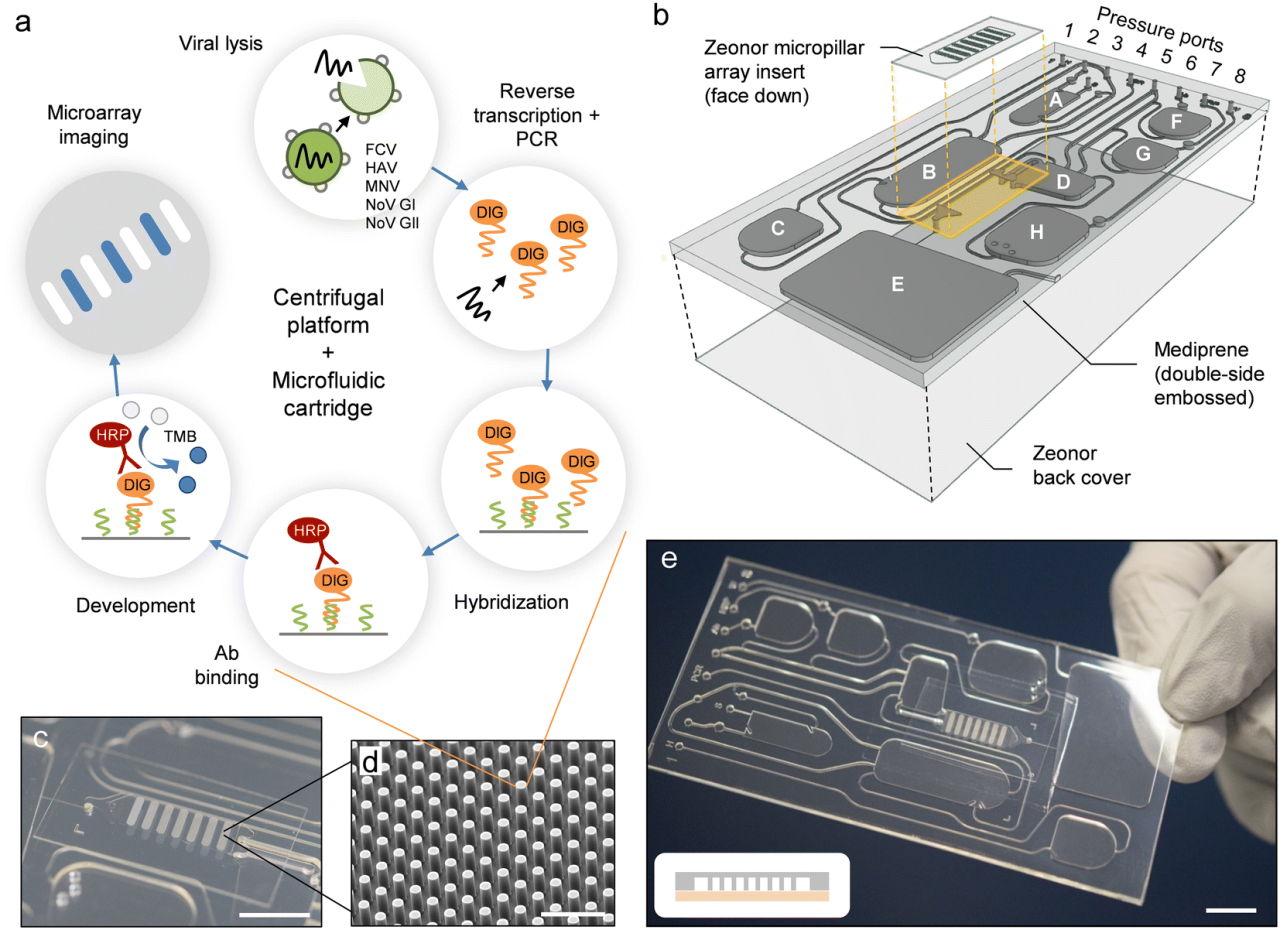 图1 从样品到结果的自动化检测过程。(a)检测原理;(b)芯片原理图;(c-d)微柱阵列的宏观/微观图;(e)组装好的芯片图 芯片中心部分主体材料为2mm厚度TPE,首先通过光刻工艺在6〃硅晶片上制备主体芯片所需的腔室和流道结构。然后通过PDMS作为载体,结合倒模来获得EpoxymTM(环氧树脂)中间体模具。耐高温环氧树脂模具坚固耐用,在热压、浇筑、脱模等微加工过程中不会断裂,可以节省时间和反复外加工带来的模具成本,尤其是针对工艺复杂的SU-8硅模具。随后通过热压成型将EpoxymTM中间体模具上的结构复刻到TPE主板上。最后采用125μm厚度聚碳酸酯(PC)板作为密封层。PC板上提前预留了矩形切口,用于后续表面改性的微柱阵列的组装。微柱阵列是在Zeonor ZF14-188 (Zeon Specialty Materials,San Jose,CA)基底上通过氧等离子体使用反应离子蚀刻系统制备而成。得到所需的微柱阵列后通过点样和孵化过程在阵列上修饰检测所需的寡核苷酸探针(表1)。  表1:用于多重杂交试验的寡核苷酸探针 片上从样品到结果的检测:在旋转平台上使用压力介导驱动方案的优点之一是可以通过向离心力场泵送液体来诱导双向流动。在传统的离心系统中,单向流动(远离旋转中心)占主导地位,通常需要将储物腔放置在靠近旋转中心的位置。这里使用的平台的压力介导驱动方案提供了在芯片上任何位置容纳储液腔的自由度(图 2)。储液腔 A-C 和 F-H 都配备了出口通道,压力端口(连接到气管盖)用于给液体施加压力,一旦施加的气动压力足够高,足以使下游通道或储液腔中的流体前沿置换,就会发生下游转移。将流体移入和移出储液腔的通道相对较大(例如,300 和 500 μm),以确保液体快速有效地转移。通过狭窄的通道(例如,50 μm)将微柱阵列和废液腔E连接起来,从而产生更高的流动阻力,这使得完全填充转移储液腔D并控制微柱阵列的孵育时间变得更加稳定。用于进行样品裂解 (A) 和 PCR (B) 的腔室均与平台上的热电加热元件对齐,以便调节和维持这些储液腔内的温度。嵌入的聚合物微柱阵列板(图1c和d)用于杂交和检测。与平面(非结构)底物相比,这种阵列可以增强比色信号,同时还有助于通过芯吸限制探针分子。微柱阵列放置在滤芯顶部,结构化面朝向 TPE 层。该模板具有七个具有相同配置的细长条形阵列:每个阵列中的微柱直径为 d = 18 μm,并以对角线方形晶格的形式排列,平移矢量 a = 40 μm。一旦放置在柱子上,微柱阵列就会提供一个流通室,其深度由柱子高度h决定(此处进行的实验h = 37μm)。微柱的方向垂直于流动方向,以最大限度地提高支柱和液相之间的相互作用。热电加热器靠近微柱阵列下方,允许在杂交过程中调节温度(45 °C)。 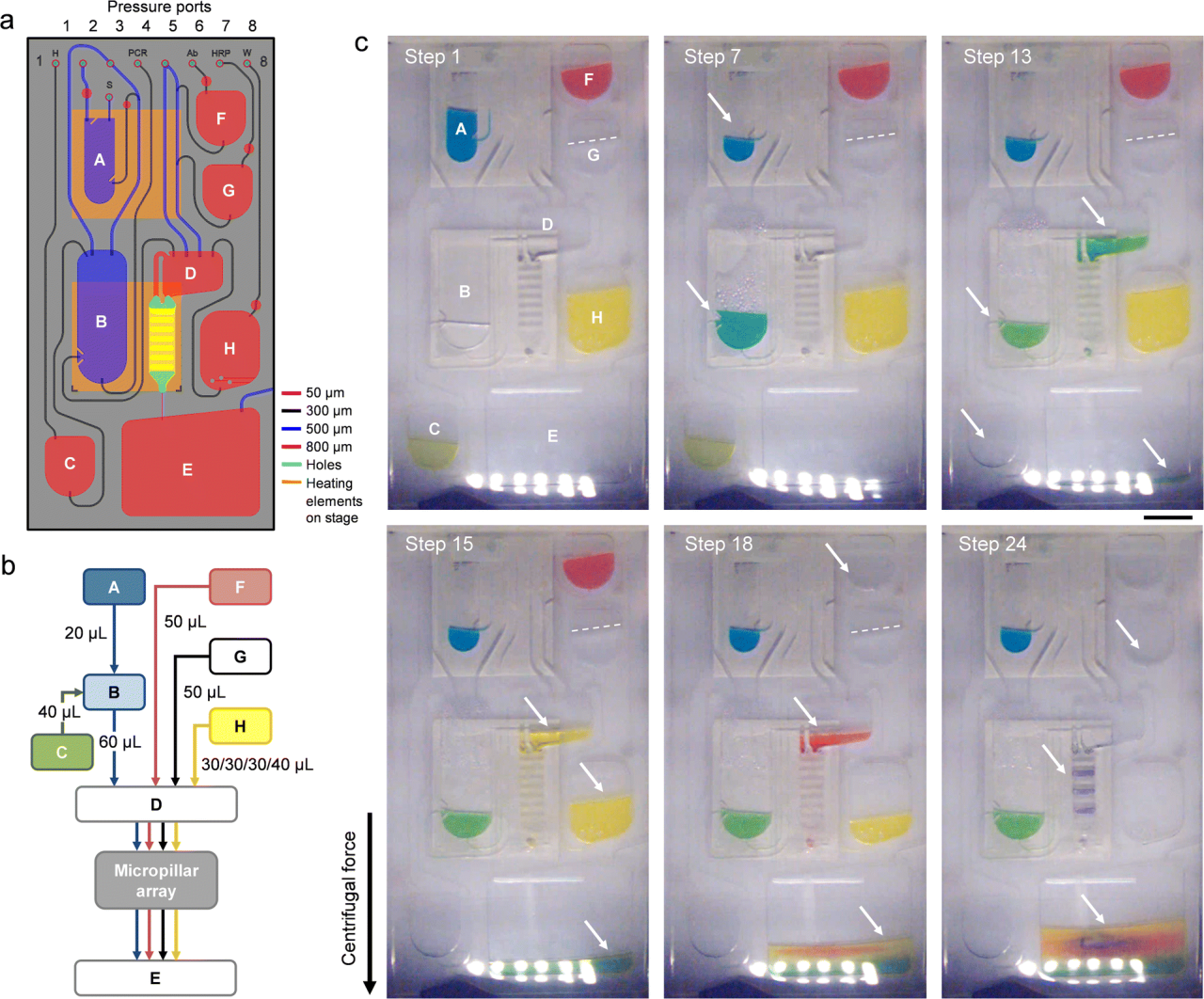 图2 微流控芯片操作功能 (a)流体设计;(b) 简化的流程图;(c)不同阶段芯片流体运动图 在完整的芯片上全流程Sample-To-Answer过程中,在相应的储液腔中加入RT-PCR主混合物30 μL,含4 M尿素代替甲酰胺的2× 50 μL杂交溶液(HS),50 μL 在 PBST-B 中以 1 : 1000 (v/v) 稀释的抗 DIG Fab 片段-过氧化物酶偶联物、50 μL TMB 膜过氧化物酶底物(SeraCare,Milford,MA)和 130 μL PBST (含0.5% (w/v)蛋白阻断剂;Bio-Rad, Mississauga, ON)。使用手动移液在每个储液腔注入溶液,通过专用进样口将 30 μL 加标有 IPC DNA 的 HAV 样品加入裂解室,随后用透明胶带密封。将20 μL的裂解液转移到PCR室,其中含有约7000个HAV基因组拷贝和2000个IPC DNA序列。芯片连接到气动接口并固定在旋转台上。PC99导热垫被用作传热界面,用于在裂解和PCR扩增步骤中的高效热传递。该平台通过LabVIEW接口(National Instruments,Austin,TX)进行操作,可以完全自动地执行微流控协议(表2)。该表详细介绍了集成协议的不同步骤以及用于操作平台的参数。微柱的图像(图2b和c)进一步说明了测定过程中流体的位移。一旦平台开始旋转(步骤1),液体就会被离心力推到各自储液腔的底部。为了进行热裂解,激活热电加热器以在95°C下在储液腔A中孵育病毒样品(步骤2)。平台的旋转有助于排出从液体中冒出的气泡,并减少腔室上部的冷凝水。完成后,关闭加热器,让裂解物冷却至室温(步骤3),然后将20μL的计量等分试样转移到含有预混液的PCR室(B)(步骤4)中。储液腔 A 上的出口通道的位置使得计量等分试样从裂解室底部沉淀的颗粒中清除,使该过程与基于微珠的病毒病原体提取方法兼容。裂解物和PCR试剂通过产生从储液腔B底部上升的气泡流来混合(步骤5)。 气泡诱导对流已被证明是离心微流体中搅拌溶液的有效手段。然后对平衡的混合物进行热循环(步骤6-9)。微柱的设计和热界面均经过优化,以确保PCR热循环的高效传热。在加入HS并混合(步骤10和11)后,将组合溶液转移到储液腔D(步骤12),从那里流过微柱阵列(步骤13)。平台以中等速度(即 350 rpm)旋转以保持杂交约10 分钟。扩增溶液被收集在废液腔E中。然后将微柱阵列干燥(步骤14)并用来自储液腔H的洗涤缓冲液(步骤15和16)冲洗两次,以除去吸附在表面上的非特异性扩增物。该平台能够通过在短时间内对储液腔 H 加压来转移多个等分试样的洗涤缓冲液。然后将抗体偶联物从储液腔F转移并与微柱阵列孵育10分钟(步骤17和18)。在微柱阵列的干燥和洗涤(步骤19-21)之后,TMB从储液腔G(步骤22)接合。随后进行图像测定(步骤23),最后干燥(步骤24)。蓝色条带表示探针与其互补的DIG标记扩增子之间的成功杂交,揭示了病毒靶标的存在。 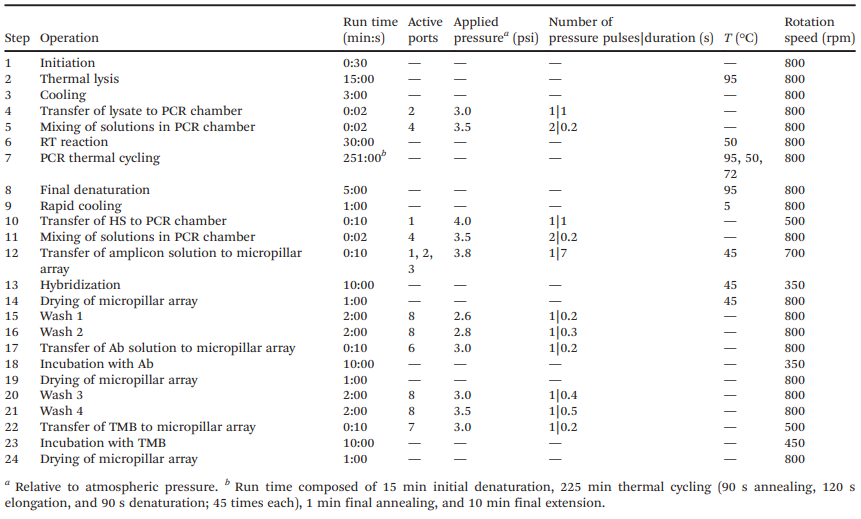 表2:操作流程 检测验证:该检测方法可同时检测所有五种靶病毒,脱靶效应可忽略不计,并且能够根据扩增产物的大小区分扩增产物。检测方法的开发和优化还包括选择RT-PCR扩增试剂盒、添加RNase抑制剂以及PCR循环的热分布。无论反应中是否存在其他核酸模板,IPC的扩增都是有效的。当来自所有五种靶病毒的病毒RNA和IPC DNA同时扩增时,优化的多重RT-PCR反应会产生六个不同的扩增子条带,其条带位置对应于预期的扩增子大小。对于大多数单重和多重检测,来自片上扩增和台式仪器的PCR产物的条带强度相当,这表明与台式方法相比,只需略微调整循环时间即可实现高效的片上扩增。在没有靶RNA的情况下,仅扩增IPC序列。使用一组寡核苷酸探针(表 1)鉴定微柱阵列底物上的扩增子,该探针允许以多重形式检测五种病毒病原体。比色测定的结果是一个定性的“是/否”答案,其中蓝色条带算作阳性,非蓝色条带计为阴性。扩增的片外检测(图3)既可单个靶标也可以组合(即1-5个靶标+ IPC)进行。存在序列相似的情况下,发生的交叉反应会导致多重杂交检测中出现假阳性信号。使用单重扩增子进行杂交以测试每个探针/靶标系统的特异性。由于探针设计经过优化以提高特异性,没有观察到探针和非靶标扩增子之间的交叉反应性。对于某些探针/靶标系统,比色信号的强度可能略有不同,因为已知表面结合杂交对多个参数表现出复杂的相关性,包括探针接枝密度、股线间二级结构的形成,以及溶液中的扩增子电荷和浓度。此外,当使用具有相对较长悬垂端的扩增子时,动力学效应以及互补链的重新结合会破坏探针/靶标双链体的稳定性。  图3 通过被动孵育的比色病毒测定中的代表性微柱阵列显色图 通过使用 HAV 病毒储备液和加标 IPC DNA 执行表 3 中的方案,进行了完整的从样本到结果的流程。在微柱阵列插入物上可以看到两条蓝色条带(图4a),确认原始样品中存在HAV和IPC。基于图像分析的端点检测可以区分正波段和负波段的信号强度(图 4b)。使用平台上的频闪成像系统,还可以实时监测和记录色度响应(图 4c),一旦转移到微柱阵列上,就可以在几秒钟内观察到与 HAV 和 IPC 相关的比色信号的出现。随着彩色颜料沉淀在聚合物表面,各个微柱阵列最初明亮的色调逐渐变暗。随着时间的流逝,表面上彩色颜料的积累增强了对比度的差异,而负波段记录的信号基本保持不变。自动化微流控系统能够使用平台上的成像设备以可靠的方式检测病毒RNA,以便进行读出。 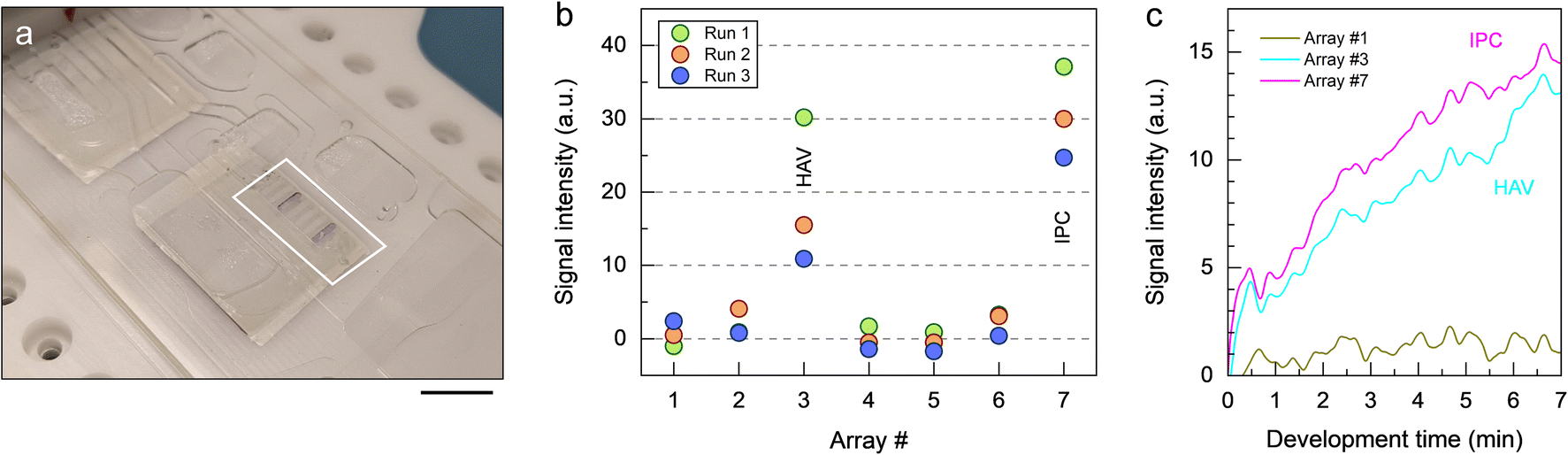 图4 (a)分析工作流程完成后的芯片照片;(b) 每个阵列的比色信号散点图;(c)频闪成像系统记录的信号变化 微柱阵列上的颜色分布和流量:在宏观尺度上,通常在芯片上进行的检测中观察到的颜色分布模式(图5a)具有两个共同特征。首先,平均而言,前导和后导阵列比腔室中间的阵列显示出更高的信号强度(图 5b)。这一发现与彩色颜料数量 n 的趋势一致 (图5c)。通过数值模拟预测了微柱阵列的流体运动情况,这些阵列以渗透率κ和孔隙度ε定义。由于腔室布局,位于入口和出口附近的前导和尾随阵列分别暴露在发散和收敛的流线中。因此,流经上部和下部阵列的液体多于流经中间阵列的液体,其中流线平行传播。这一发现通过数值模拟得到证实,这些模拟比较了具有较高和较低渗透率的微柱阵列,它们都显示了整个腔室速度场的固有变化。模拟显示离心力和科里奥利力(Coriolis)对这种效应没有显着贡献。从仿真中也可以明显看出,对于此处使用的阵列,外围的流速比结构区域内的流速高出约5 倍。外部区域和内部区域之间的速度差相当于 4 : 6 的体积分配比(考虑两侧的流动组合),这是通过计算出的流动剖面积分确定的。模拟结果与使用荧光微粒实时观察流动的结果一致(图5d和e),其中外围流线的密度明显高于阵列内部的密度。将阵列延伸到腔室壁提供了一个合理的解决方案,以防止液体绕过结构化区域。 颜色分布模式的第二个特征是,每个阵列内的信号从上边缘到下边缘,从外端向中心逐渐减少。根据垂直和水平扩散确定了颜色分布(图 5f),分别对比了左侧和右侧的上边缘 (i) 和下边缘 (ii) 以及中心 (iii) 和边缘 (iv) 之间的差异。将孵育时间从10分钟延长至25分钟仅轻微改善。另一方面,将模板与更深的腔室一起使用,其中微柱完全浸没在液体介质中(即凹槽配置),被证明有助于增强信号均匀性。以这种方式获得的比色响应与被动孵育(片外)得出的结果相当,其中信号最终由点样过程中实现的探针分子分布决定,而不是由预定的流动模式决定。对于此类阵列,每个方向的点差通常低于 20%。这些观察结果在实时记录信号演变的实验中得到证实(图5g)。对于凹槽微柱阵列配置,无论其位置如何,条带之间的色度响应变化都很低(例如,8.5%)。 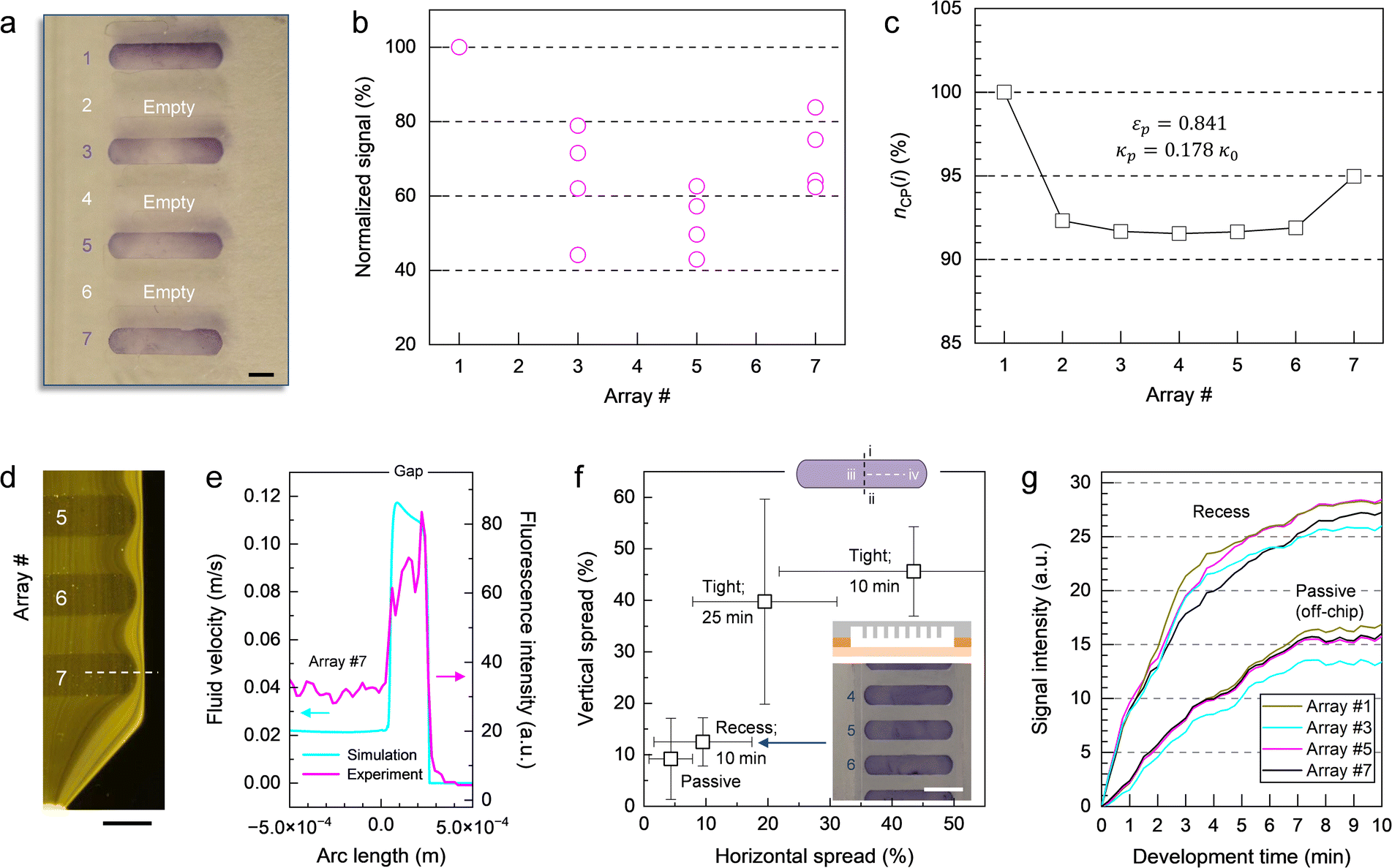 图 5:(a) 在流动条件下获得的微柱阵列的照片;(b)比色响应随阵列位置变化图;(c)通过数值模拟确定的每个微柱阵列的归一化染料含量;(d)微柱阵列内流动的荧光显微照片;(e)荧光强度曲线模拟/观察结果;(f) 不同工艺条件和微柱阵列实施产生的颜色分布图;(g)与被动孵育相比微柱阵列实施的信号演变图; 总结 本文描述了一种集成的离心式微流控检测系统,该系统使用基于聚合物的微流控芯片和带有气动驱动的离心平台来检测和鉴定病毒病原体。分析工作流程包括预纯化病毒储备液的片上热裂解、靶标特异性 RNA 基因标记物的多重扩增,以及与比色测定相结合的杂交,通过微柱阵列上线条变色,表明样品中存在靶病毒含量。该系统可以通过将PCR扩增的标记基因与在嵌入式聚合物微柱阵列上实现的一组靶标特异性寡核苷酸捕获探针杂交来准确区分阳性和阴性样本。以从样品到结果的形式获得比色信号也证明了这样一个事实,即测定中涉及的敏感试剂(例如,过氧化物酶标记的抗体和TMB)在其各自的储液腔内保持活性,并且不会受到暴露于光(即来自频闪成像系统)和高温(在裂解和PCR热循环期间柱子受到的高温)的不利影响。用于测试目的的病毒载量(例如,每μL350个基因组拷贝)对于从受污染食品中回收、检测和定量HAV(和其他病毒病原体)具有实际意义。虽然没有测试较低水平的起始样品,但检测限可以作为该技术的未来工作进行评估。芯片的包装和保质期等关键商业化要求仍待进一步验证和研究。初步观察表明,微柱阵列在环境条件下储存时可保持其功能数月。如果与适当的数据处理软件相结合,频闪成像系统的实时采集功能可以在显色过程的早期识别正负信号。该系统相对高的集成度最大限度地减少了对片外样品制备步骤和相关仪器的需求,使该设置适合在没有实验室级基础设施的地区进行部署。该检测完全在微流控芯片内进行,因此该系统易于使用,仅需简单的操作和数据分析培训。 论文链接:DOI: 10.1039/d3lc00904a 原创:“扬清芯片” |

