|
|
浙江大学研发可溶性微针贴片,实现肿瘤部位的均匀及精准给药Issuing time:2021-12-16 13:16 基于纳米医学的光动力疗法(PDT)在皮肤黑色素瘤的治疗中表现出良好的应用前景。目前多采用静脉注射或瘤内注射进行给药,前者为达到足够的病灶部位浓度,往往要给予患者大量光敏剂,存在一定的安全隐患;后者会出现瘤内分布不均匀及药物全身泄漏等问题。 据麦姆斯咨询报道,近日,浙江大学药学院高建青教授课题组基于前期微针方面的研究基础(Nano Today 2021, 36, 101030-101045;ACS Nano 2021, 15, 8, 13759–13769),研制了L-Ce6负载的可溶性微针贴片,实现肿瘤部位的均匀及精准给药,经激光照射可产生大量活性氧(ROS),诱导肿瘤免疫原性死亡,启动T细胞介导的全身免疫反应,达到抑制原位和远端肿瘤生长的目的,最终有效延长荷瘤鼠的生存率。该研究以“A Facile Low-Dose Photosensitizer-Incorporated Dissolving Microneedles-Based Composite System for Eliciting Antitumor Immunity and the Abscopal Effect”为题发表在《ACS Nano》上。  L-Ce6 MNs由可溶性寡聚透明质酸为基质,经两步离心法制备而成。每个贴片大小约为1平方厘米,包含225根高500μm的金字塔形微针,针尖处富集了共约3μg的Ce6光敏剂。在小鼠双侧B16F10黑色素瘤模型中,微针能够有效刺入肿瘤深处、溶解并快速释放。经激光照射,L-Ce6 NA可释放大量活性氧(ROS),高效消融原位肿瘤,诱导肿瘤细胞免疫原性死亡(ICD),释放肿瘤相关抗原(DAMPs),促进肿瘤引流淋巴结内DC细胞的成熟,启动全身免疫,有效延长荷瘤鼠的生存率。重要的是,在未添加免疫佐剂或使用其他免疫疗法制剂的情况下,该微针贴片仍旧显著抑制了远端肿瘤。另外,该微针贴片在室温干燥条件下储存一年后,其中装载的纳米粒仍能保持原有形态和功效。 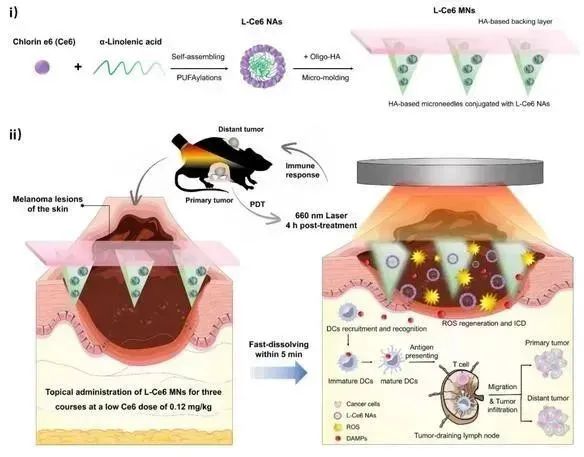 图1 L-Ce6 MNs光动力激活免疫疗法用于原位及远端黑色素瘤的治疗示意图 综上,该微针贴片具有以下优点:本研究中纳米药物的设计及微针的制备方法均简单可控,所使用的材料在医药领域均已被广泛应用,具有较高的安全性;该微针贴片凭借微量的光敏剂,在不借助其他免疫治疗手段的情况下有效激活了全身抗肿瘤免疫反应;该微针贴片无需冷链运输存储,剂型稳定性较高,具有较好的转化前景。 高建青教授团队在经皮给药领域深耕多年,致力于透皮新制剂、皮肤急慢性创伤修复及雄激素源性脱发治疗等相关的工作,已在国内外发表透皮相关论文80余篇,建立透皮制剂相关校企联合研发中心2个。本工作发表在《ACS Nano》上,也是课题组继可溶微针治疗雄激素源性脱发后对组内微针平台技术的又一拓展与应用。论文的第一作者是药学院博士生边琼,共同第一作者为药学院2021年博士毕业生黄领领,黄领领博士目前为附属第二医院特聘副研究员,通讯作者为高建青教授。 原文链接: https://pubs.acs.org/doi/10.1021/acsnano.1c06225 文章来源:麦姆斯咨询(“微流控”公众号) |

