|
|
前沿资讯 | 一种用于器官型培养和人类与啮齿动物胰腺切片序列评估的微流控平台发表时间:2024-01-22 14:09 大家好!今天为大家分享一篇2024年发表在Lab on Chip上的文章,题目为“SliceChip: a benchtop fluidic platform for organotypic culture and serial assessment of human and rodent pancreatic slices”。 迈阿密大学生物医学工程系Charles G. Alver团队在Lab on a Chip期刊上发布了一种新型的胰腺芯片(SliceChip)。该芯片平台允许介质储层之间的高效切换,对溶解氧的精细控制,以及无气泡和无泄漏操作,这对长期微流控培养至关重要。该研究通过结合SliceChip和流体控制平台,展示了一种支持长期培养和一系列功能评估的台式设备,可同时对原代人和小鼠胰腺切片进行实时成像。 研究背景 40多年来,研究人员一直使用酶法分离的人胰岛来研究糖尿病的发病机制和新治疗方法的开发。然而这些模型只捕捉到了胰腺的复杂结构和糖尿病患者整个器官(外分泌和内分泌)变化中的一小部分。虽然采用胰腺切片是不错的胰腺解剖和功能模型构建方案,然而胰腺切片需要一个高氧消耗率的高氧环境,长期的切片培养存在困难。此外,细胞代谢物可以在切片周围迅速积累,影响细胞的反馈回路。 更重要的是在静态培养中,由切片产生的消化酶会迅速恶化切片的细胞结构。 因此,长期的切片培养需要频繁地改变培养基,以防止细胞降解。对于切片的功能评估,葡萄糖刺激胰岛素分泌(GSIS)研究通常在一个非无菌的开放环境中使用多个切片,限制了重复分析单个切片反应的能力。具有多个自由漂浮切片的培养物也很难在不影响无菌性和可靠性的情况下重复成像,因为在培养基变化和成像过程中,切片往往会在培养物内移动。因此,捕获高分辨率图像(每4-6小时,持续几天)需要大量的人工干预,在恒温箱和成像显微镜之间转移切片,在连续成像过程中存在重大污染风险和运动伪影风险。 基于此,微流控平台上的器官芯片存在其优势,器官芯片通过其独特设计,模拟出接近生理学的氧气和灌注环境以维持切片活力,并通过激素分泌和连续荧光成像研究胰腺生理学。迈阿密大学生物医学工程系Charles G. Alver团队在Lab on a Chip期刊上发布了一种新型的胰腺芯片(SliceChip),其特点包括:优化了对流体流动设计、使用生物惰性和非吸收材料、可逆组装人工胰腺切片加载和卸载,以及与商业成像系统直接集成形成实时观测。该芯片平台允许介质储层之间的高效切换,对溶解氧的精细控制,以及无气泡和无泄漏操作,这对长期微流控培养至关重要。该研究通过结合SliceChip和流体控制平台,展示了一种支持长期培养和一系列功能评估的台式设备,可同时对原代人和小鼠胰腺切片进行实时成像。 图文导读 胰腺芯片设计:SliceChip的设计目的是保持培养中人或鼠胰腺切片组织完善的同时不限制其可视化,并且可以进行连续灌注或在实验后恢复组织样本。通过精确切片提取了人体的一部分胰腺组织切片(图1),保持内分泌和外分泌细胞的原始结构,厚度为120 μm。供体组织被清洗并切片成小块,嵌入琼脂糖组织圆柱体中用切片机进行切片。将切片从切片机中取出,在35 mm的培养皿中培养,随后放入SliceChip中。 SliceChip采用3D CAD软件设计,具有两个直径8 mm,深度1.5 mm的培养孔,具有独立的流路,允许在不同条件下同时分析两个切片。SliceChip由两个光学透明PMMA片组成。与基于PDMS的芯片不同,该密封SliceChip可以很容易地打开,移除切片,清洗、消毒和重复使用。芯片被夹在微管夹中,通过芯片顶部的硅酮聚合物垫片实现流体通道的密封。芯片顶部上的孔位和芯片夹具上的进样口一一对应,可用作流体入口和出口。为了改善在流动条件下拍摄的切片图像中的运动虚像,该团队使用3D CAD软件开发了一个芯片夹具,以保护切片的安全且不受传统固定方法引起的介质和溶质扩散的限制。芯片夹具是一个直径为8mm,有0.5mm厚度的圆盘,中心直径为25mm。它被设计成只对残留在组织切片外部的琼脂糖施加力,以防止切片移动。其外环厚度0.5mm,而内网格为0.375mm厚,在网眼下方留有一个接近人或鼠胰腺切片厚度间隙。由于切片与其接触的时间较长,因此采用316 L不锈钢打印,该不锈钢具有很高的生物相容性,常用于植入式医疗设备。 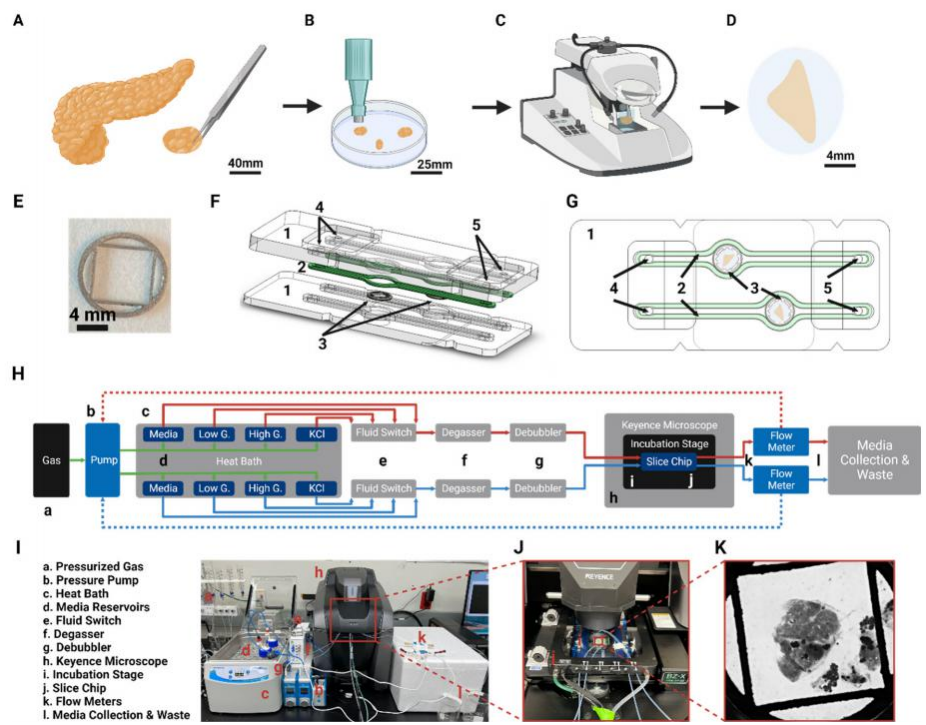 图1 胰腺芯片及其工作平台 流体动力学的计算分析:利用COMSOL多物理软件对SliceChip的流体动力学进行了建模。主要目标是在切片培养过程中进行GSIS实验,利用模型来计算芯片中的葡萄糖洗脱时间,以方便选择在芯片中使用的体积流量。使用将芯片内液体流动和葡萄糖扩散耦合的多物理模型,来计算在不同的流速(20-80μl/min)下所需的洗脱时间。系统从0 mM葡萄糖浓度开始,使用阶跃函数快速将入口浓度调到5mM;记录切片上方的平均浓度,并绘制随着时间推移(图2 ) 的变化图。设定目标为从入口到出口的总时间不超过3分钟,这样就可以在较高的时间分辨率下将离散的样本收集与注射时间连接起来。在系统的死体积为140 μl,流速80 μl/min 时,进出口时间为2.95分钟;当流速为70μl/min 或者更低时,总时间会超过3分钟。使用选定的体积流量,当速度为80 μl/min时,流体压力和剪切应力分布如图2 B – D所示。 尽管液体在入口和出口通道中快速移动,但液体通过较大的孔和胰腺切片周围移动的速度明显较慢,不超过200 μm/s。该系统在芯片上显示了均匀的压力梯度,芯片内的流体流动也会在切片周围产生剪切应力。剪切力在切片顶部表面边缘的切片表面垂直于流动方向的边缘最大。大部分切片剪应力低于1 mPa,即使在最大值1.2 mPa时,剪应力也远低于对组织造成损害的水平。 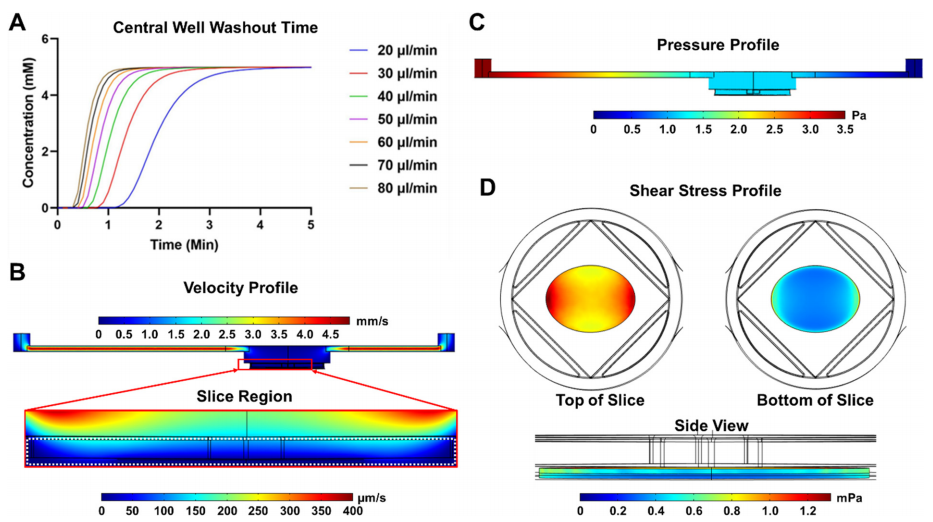 图2 SliceChip流体参数的计算模型 气泡消除和含氧量调节:流体运动过程中形成的气泡不利于器官芯片中的组织培养,气泡会限制或阻断流体流动,从而影响细胞生长。当流体流过芯片时,压力下降,介质中的气体变得过饱和,小的成核点为气泡的形成创造了条件。最初的实验在24小时内结束,因为过度的气泡形成停止了系统内的流动。为了防止气泡的形成,通过在培养基储层和培养井之间提供一个轻微的温度梯度(37-30°C)来防止培养基的过度饱和。虽然增加温度可以改变溶解度,从而减缓了气泡的形成,但这不足以消除气泡。因此更为合理的方式是采用分压,通过脱气室在透气性流体上形成真空,以消除流动介质中的溶解气体。除气器的效率与除气管的长度和每个介质的流速直接相关。考虑到该系统需要增加对胰腺切片的氧气输送,脱气培养基可以在延长培养时间内产生无泡培养基。然而,该方法造成了一个新的问题——脱气培养基中的残余氧水平将低于切片培养的理想水平。为了解决这个问题,通过用由95% O2组成的复合气体加压介质,来补充最初溶解在介质中的氧气量,采用5%的二氧化碳维持pH值。用添加氧和加压培养基重复分析残余氧水平,分压为70mmHg (图3 ) 。为了使残留物与大气水平保持一致,修改了除气器管的长度,去掉了35mm。这导致了120 mmHg的残留量(图3)。通过调节除气管的长度和在介质中掺杂加压复合气体,能够有效地创建一个可变氧水平的无气泡系统。 胰腺切片的充分含氧已被证明是重要的切片培养维持条件。需要将切片内的正常氧张力维持在30-50mmHg的生理范围内或超过上限,使用稀物质传递模块创建了一个在SliceChip中的稳态耗氧量的3D COMSOL模型。流入培养孔的氧气通过多物理模型与层流模块计算的芯片流体动力学耦合计算。在培养孔的底部分配了一个切片模拟物,最大耗氧量(OCR)为0.03 mol/ m3.s 。模拟的切片是不移动的,其下面有一个小的间隙(10 μm),以模拟锚下的间隙和切片厚度之间的高度差,允许介质在切片下流动。采用标准除氧器和改良除气器分别输入低氧(70 mmHg)和正常氧(120 mmHg)模拟切片的氧水平 (图3 ),含氧水平低于0.1 mmHg被认为是缺氧的。正常和低氧系统都没有产生低于这个阈值的区域,各自的最小值分别为52.1mmHg和2.1mmHg。模型显示,随着切片从入口到出口,从外到内,从上到下移动,切片中的氧水平随着浓度的降低而形成一个梯度。计算模型显示了SliceChip内的平衡梯度,并且在培养过程中是一致的。稳态消耗模型中的总体残余氧显示出类似的操作范围和水平(正常和低氧系统分别为115-52mmHg和65-2mmHg),与之前报道的成功切片培养相当。 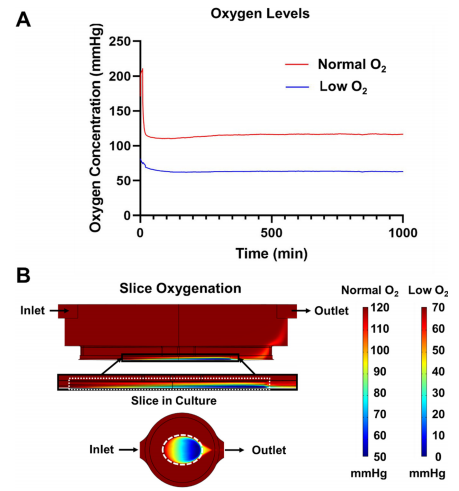 图3 稳定状态芯片内充氧过程 重复评估葡萄糖刺激的胰岛素分泌(GSIS):传统上,OoC培养物的环境条件是由培养箱控制的;然而,这限制了在不干扰其环境的情况下连续成像的能力。常用的GSIS灌注组件也需要从培养箱中取出切片,这限制了进行一系列评估的能力。为了创建一个可以连续成像、灌注和刺激切片系统,研究采用了传统的OoC培养和显微镜结合的培养方式,以保持所需的无菌、温度和O2 与CO2条件。 在Keyence BZX 810荧光显微镜下耦合芯片灌注和气氛控制系统。为了确保液体通道内的无菌性,系统的所有部分都进行了预消毒,并组装在无菌培养罩中。温度和气体环境控制的密封流道与荧光显微镜内部的结合,创建了一个可以连续成像和进行GSIS实验的系统。GSIS指标是一种用于监控的标准方法。传统上都是将一组多个切片从无菌培养箱移动到非无菌平台,灌注后立即固定和染色。与这种对胰腺切片进行GSIS评估的方法相比,该无菌SliceChip提供了一种独特的能力,可以在几天内对同一胰腺切片进行重复的GSIS评估。SliceChip的独立液体途径允许同时对不同氧条件下的单个个体切片进行GSIS评估,以评估氧合对GSIS的影响。胰岛素分泌谱,归一化为切片胰岛面积,对于在正常和低氧条件下培养的切片,图4中数据的平均值和范围分别用实线和阴影区域表示。在第2天和第3天,保持在正常氧水平下的切片在葡萄糖刺激下出现了生理胰岛素峰值,而在低氧水平下培养的切片则显示出迟钝的反应。在第2天和第3天的切片之间的反应水平似乎相似。相比之下,在正常和低氧条件下,第5天的胰岛素水平均出现峰值,但与第2天和第3天相比,峰值幅度下降。通过评估葡萄糖刺激前、刺激期间和直接刺激后的AUC,以进一步研究不同氧条件下的切片反应性(图4 D ) 。对第2天和第3天高糖刺激的AUC进行非配对检验,显示正常和低氧条件下的胰岛素分泌具有显著性。虽然在第5天高糖间隔期的正常和低氧条件下似乎存在差异,但统计分析尚不清楚。单独分析比较高糖刺激的AUC静态控制切片和切片在正常氧流条件下,发现第2天具有统计学意义;而第3天和第5天缺乏意义。 对各氧条件下3 mM和16.7 mM葡萄糖刺激的AUC进行配对检验,结果显示切片保持在正常含氧条件下表现出显著的差异;在3 mM和16.7 mM下第2天和第3天胰岛素分泌的葡萄糖,在低氧条件下无显著性差异。两种情况下的第5天分析均不显著。计算AUC刺激指标(16.7mMGAUC与3mMGAUC的比值),评估低糖和高糖刺激期胰岛素分泌的差异。每种情况下都表现出刺激指数>1(高糖期比低糖期释放更多的胰岛素)。刺激指标的平均值和标准差如图所示,在第2天和第3天,正常氧条件下的切片刺激指数高于低氧切片;然而第5天的情况却恰恰相反。结果证明该团队的SliceChip能够执行重复的GSIS灌注评估,并在几天内从同一单一的胰腺切片中恢复可测量的分析物水平。 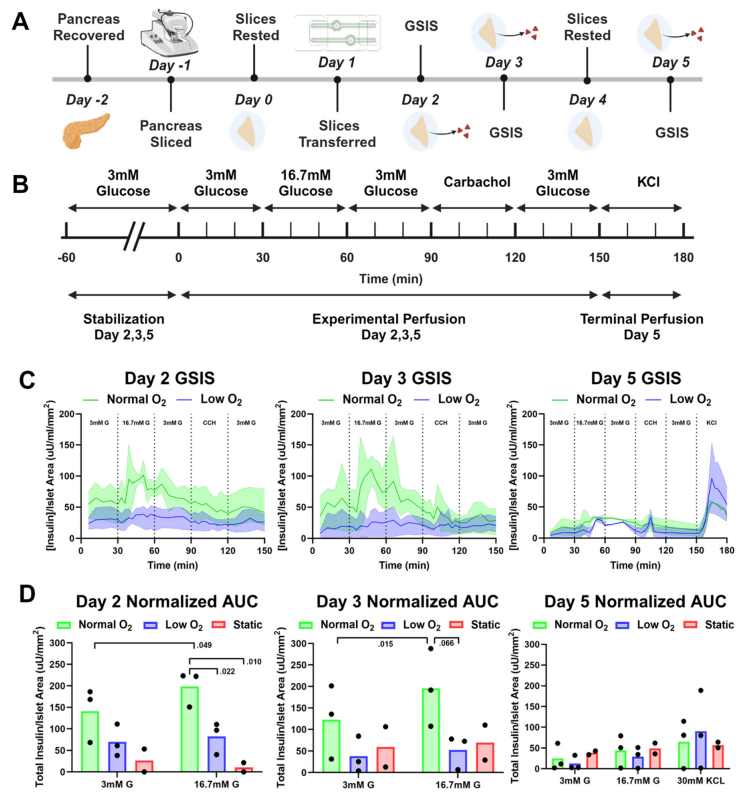 图4 葡萄糖刺激的胰岛素分泌测试 生存能力及活体成像:经过5天的孵育,包括3次3小时的灌注或静态GSIS实验,将静态培养的切片与正常和低氧条件下的切片进行比较。用活细胞和死细胞的荧光面积计算活面积与总细胞面积(活面积加死面积)的比值,作为组织活力的标志,如图5方差分析结果显示,各培养条件间均无显著性差异。图中显示了正常和低氧条件下以及静态培养的培养后活/死染色的代表性图像。虽然将胰腺切片作为一个切片内所有细胞的功能指标,但这并不是单个切片对葡萄糖刺激反应的完全代表性指标。成像图如图6显示,在切片培养后,胰岛素、胰高血糖素和胰酶的维持,作为内分泌和外分泌胰腺组织亚型的视觉标记物。在细胞单个胰岛内的胰岛素和胰高血糖素的产生共定位是明显的。虽然由于胰岛的结构在一定程度上是预期的,但它的突出也可以归因于荧光图像是3D胰腺切片的120 μm高度的全聚焦实变。持续的胰岛素分泌与高糖相关表明胰岛组织生存能力。虽然作为GSIS实验方案的一部分,通过卡巴醇刺激来评估外分泌功能,但分泌的淀粉酶水平低于0.62 mU的检测限。然而,免疫染色后的淀粉酶的存在表明了外分泌组织的维持。 为了评估SliceChip平台拍摄胰腺切片的延时荧光图像的能力,团队生成了转基因小鼠模型的胰腺切片,能够通过EGFP和td荧光显示非胰岛素产生细胞。每4小时拍摄一次Z方向的全聚焦集成图像,每个成像周期的总曝光时间为19分钟,结果显示了荧光信号在5天培养过程中的稳定性。复合亮场/EGFP/td第1、3、5天的荧光图像如图6C所示,在整个切片图像下面描绘了一个胰岛。图6D以不同的暴露长度和成像间隔(每12小时46分钟,每12小时76分钟)进行成像,以评估暴露时间对芯片内光漂白的影响。线性回归分析显示,在19、46和76分钟的暴露时间内,每天的总荧光面积分别损失了2.9%、5.5%和10.3%。考虑到这种程度的光漂白可以通过采集后处理得到纠正,低于3%的每日损失被认为是可以接受的。 总结 该研究开发了一种新型的台式无气泡的胰腺SliceChip平台,它可以在荧光显微镜下保持无菌人体胰腺切片培养,同时进行重复的连续灌注实验。通过动态环境控制能够连续分析不同水平的葡萄糖刺激对胰岛素分泌情况。并观察到在生理适当的氧水平下,切片对高水平葡萄糖的生理反应的维持,以及在低氧水平下缺乏反应。在该平台上设计和使用一个切片夹具,并与荧光显微镜系统耦合,能够在几乎无需人为介入的情况下,轻松实现高质量荧光图像的实时和重复拍摄。SliceChip平台的独特能力和动态环境为研究胰腺组织之外的各种组织切片提供了机会。该平台是研究体外组织研究的多功能工具,为未来器官芯片的发展提供了参考。 论文链接:DOI: 10.1039/d3lc00850a 前沿资讯 扬清芯片”前沿资讯“专题将于每周一为行业内相关从业者提供最新的行业资讯。往期精彩合集可在菜单栏"前沿资讯”查看。 欢迎将文章与公众号分享给更多关注微流控行业的朋友! |

