|
|
纳米电穿孔探针平台,用于活细胞增强子活性鉴定发表时间:2022-12-23 17:11 增强子是基因组中一类非编码调控元件,它能使细胞内特定的基因得到明显地上调。在基因调控的过程中,增强子在序列特异性转录因子的引导下,与相应的启动子发生作用,以激活下游基因的表达。正常的增强子激活在维持哺乳动物细胞中基因的发展方面起着重要的作用。然而,基因不可控的表达增强会导致细胞产生一系列异常的行为,如肿瘤的发生和过度增殖。鉴定增强子的活性,特别是在活细胞中,将为解析癌症中基因表达异常的机制提供重要线索。 近日,北京航空航天大学常凌乾课题组在ACS Sensors期刊上发表了一篇名为“Sensitive Interrogation of Enhancer Activity in Living Cells on a Nanoelectroporation-Probing Platform”的文章。该研究工作中发展了一种纳米电穿孔探针平台,通过采用纳米电穿孔生物芯片,利用纳米孔提供聚集的电场,实现细胞膜的可逆穿孔,同时产生电泳力,将用于增强子活性检测的探针高效地递送至细胞核内(图1)。 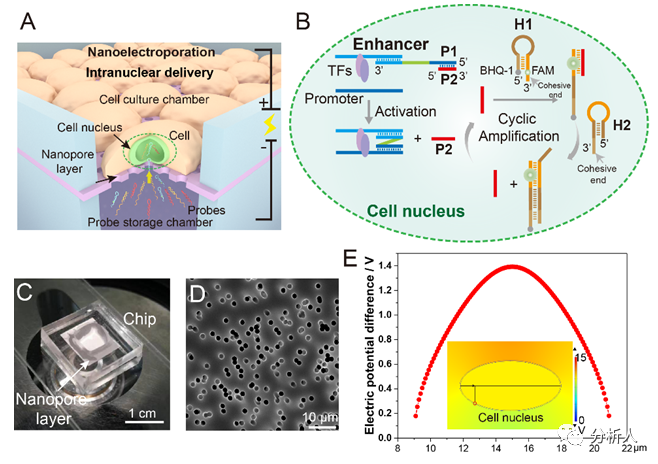 图1 纳米电穿孔探针平台用于活细胞内增强子活性鉴定:(A)纳米电穿孔探针平台工作原理;(B)PH探针鉴定增强子活性并产生放大荧光信号的原理;(C)纳米电穿孔生物芯片实物图;(D)纳米孔的电镜扫描图像;(E)细胞核靠近纳米孔附近的膜内外电势差模拟结果。 由于增强子激活基因表达的方式取决于其与启动子的相互作用,鉴定增强子活性实际上意味着评估目标增强子与启动子之间的相互作用。考虑到这种相互作用的独特性,该团队设计了一组DNA探针,名为“PH探针”。PH探针由序列P1、P2、H1和H2组成。其中,P1与P2互补结合。H1和H2可自组装为具有粘性末端的“发卡”结构。P1的3’端能够特异性结合增强子序列。当增强子与启动子相互作用,P1的5’端将与启动子序列结合,原本结合在P1上的P2被替换下来。替换下来的P2能够与H1的粘性末端结合,并打开H1的发卡结构,使荧光基团远离淬灭基团而恢复荧光。随后,H2的粘性末端将与H1结合,使结合在H1上的P2被替换下来。被替换下来的P2又能与新的H1结合,继而开始新一轮的荧光信号恢复,最终使荧光信号产生百倍增强(图2)。 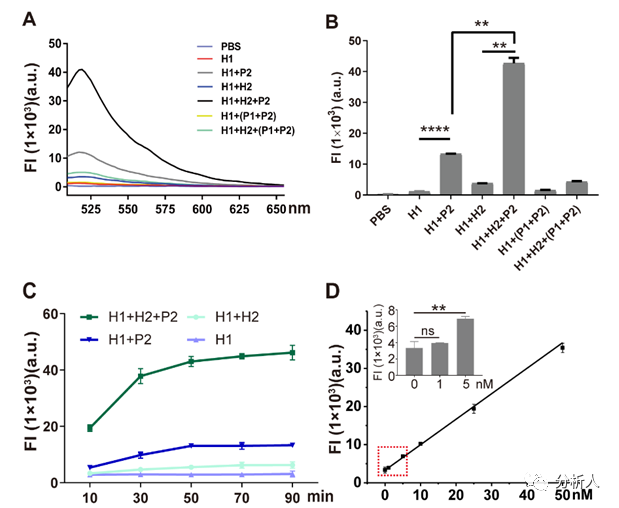 图2 PH探针的功能验证:(A)H1和H2探针对序列P2的识别能力;(B)PH探针在不同序列搭配下的荧光强度;(C)H1和H2探针检测序列P2的反应时间;(D)H1和H2探针检测序列P2的荧光强度的校准曲线,插图显示H1和H2检测序列P2的检测限为5 nM。 利用纳米电穿孔生物芯片将PH探针高效且安全地递送至活细胞内,该平台成功地在活细胞内鉴定了CCAT1增强子活性。CCAT1是一种长链非编码RNA,参与肿瘤侵袭和转移,其在肿瘤中的异常高表达已被报道与增强子激活有关。该平台将传统增强子活性检测方法的时间从几天缩短到不到一个小时,同时,保证了细胞的高活性。这为活细胞内增强子的活性检测以及细胞的行为关联分析,提供了便捷的研究平台(图3)。 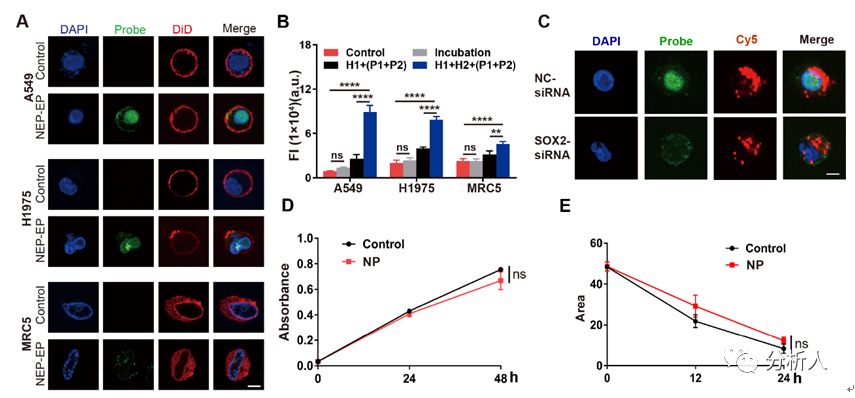 图3 纳米电穿孔探针平台检测活细胞内CCAT1增强子活性:(A)PH探针检测细胞的荧光图像;(B)细胞荧光强度统计数据;(C)采用siRNA转染A549细胞后,使用纳米电穿孔探针平台检测得到的细胞荧光图像;(D)利用CCK8试剂盒对细胞的增殖能力进行鉴定;(E)细胞迁移一段时间后的划痕区域,以表征细胞的迁移行为。 为了验证该平台的性能,该团队在22个临床原代细胞样本中鉴定了CCAT1增强子的活性,并发现在肺癌原代细胞中CCAT1增强子的活性较正常肺癌细胞明显增加,且不同细胞样本间存在异质性(图4)。 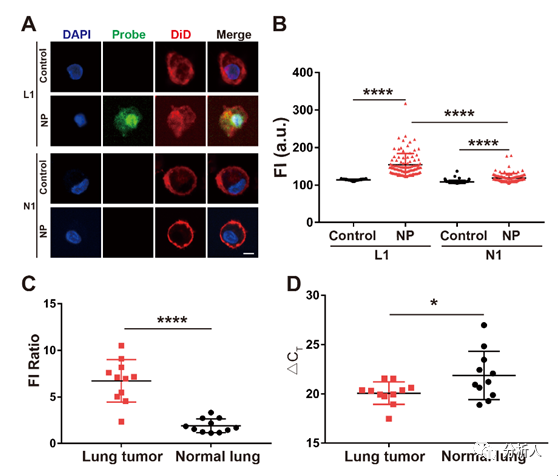 图4 临床细胞样本中增强子活性的鉴定:(A)检测原代细胞样本L1和N1的荧光图像;(B)计数100个细胞的荧光强度统计结果;(C)原代肺肿瘤细胞样本与原代正常肺细胞样本的荧光强度比值比较;(D)CCAT1在原代肺肿瘤细胞(L1-L11)和原代正常肺细胞(N1-N11)中的表达比较。 该研究工作第一作者是万凤奇博士,共同第一作者董再再博士。通讯作者北航常凌乾教授、董再再博士。文章第一单位为北京航空航天大学生物与医学工程学院,合作单位为兰州大学第二医院与北京大学肿瘤医院。 论文链接: https://pubs.acs.org/doi/pdf/10.1021/acssensors.2c01187 文章来源:麦姆斯咨询(“微流控”公众号) |

