|
|
基于微流控芯片的靶向多肽分子多维度进化方法Issuing time:2022-11-10 17:31 发展性能优良的高特异、高内涵靶向分子是实现活体化学测量的基础,也是现代分析化学领域的前沿。与其它类型的识别分子相比,具有内源活性的靶向多肽具有更高的信息量和更好的生物相容性。因此,靶向多肽在体内分子精准靶向方面具备独特优势,是有力的活体测量识别工具。然而,目前对于靶向多肽的获取方法有限,常规分子筛选和分子进化手段难以在筛选效率、筛选精度、多肽性能构象等方面获得突破。因此,亟待靶向多肽筛选新策略。 基于上述问题,近日,北京理工大学王蔚芝课题组与新加坡国立大学陈小元课题组合作,开发了基于微流控芯片的靶向多肽分子多维度进化方法。该方法可同时针对多个肿瘤相关靶标分子筛选兼具高亲和力、高特异性和高度稳定组装性能的靶向多肽,在肿瘤诊疗中显示出极大的优势。此外,该方法由于在肿瘤组织原位环境下进行分子定向进化,所获得的分子在复杂的活体环境中更具稳定性。 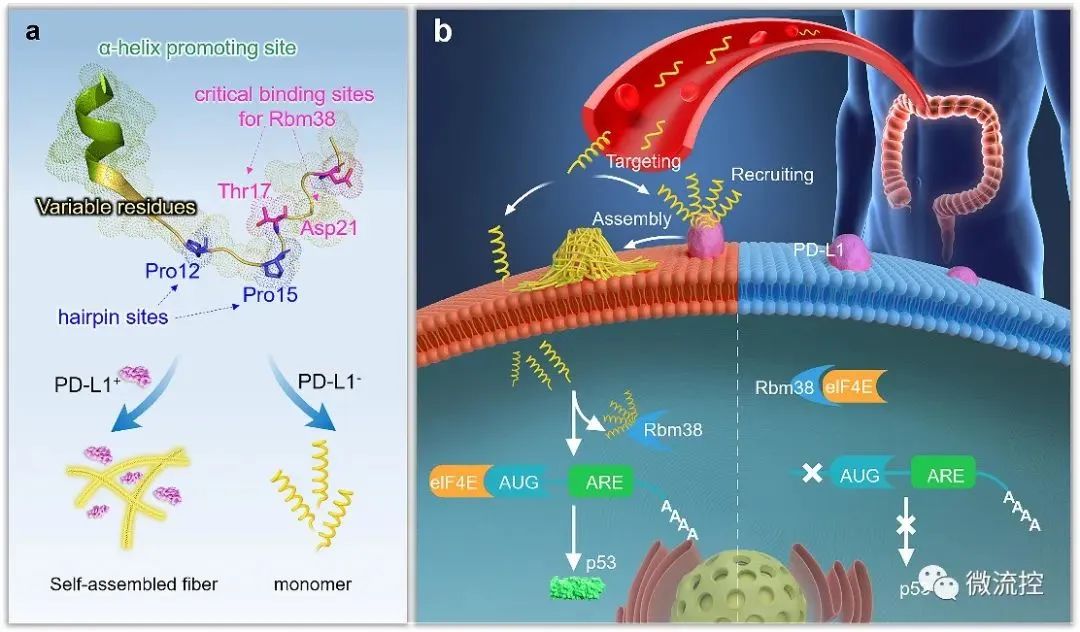 首先,通过分析靶标蛋白PD-L1与Rbm38的晶体结构,从头设计并构筑了容量为10⁵的多肽库,并在肽库中引入具有聚集诱导发光(AIE)性能的TPE分子来指示多肽的稳定组装性能。然后利用微阵列芯片上的三维进化策略在结合能力、自组装性能以及特异性三个维度进行了肽库筛选,优化出了一条具有高内涵性能的靶向多肽TAP。 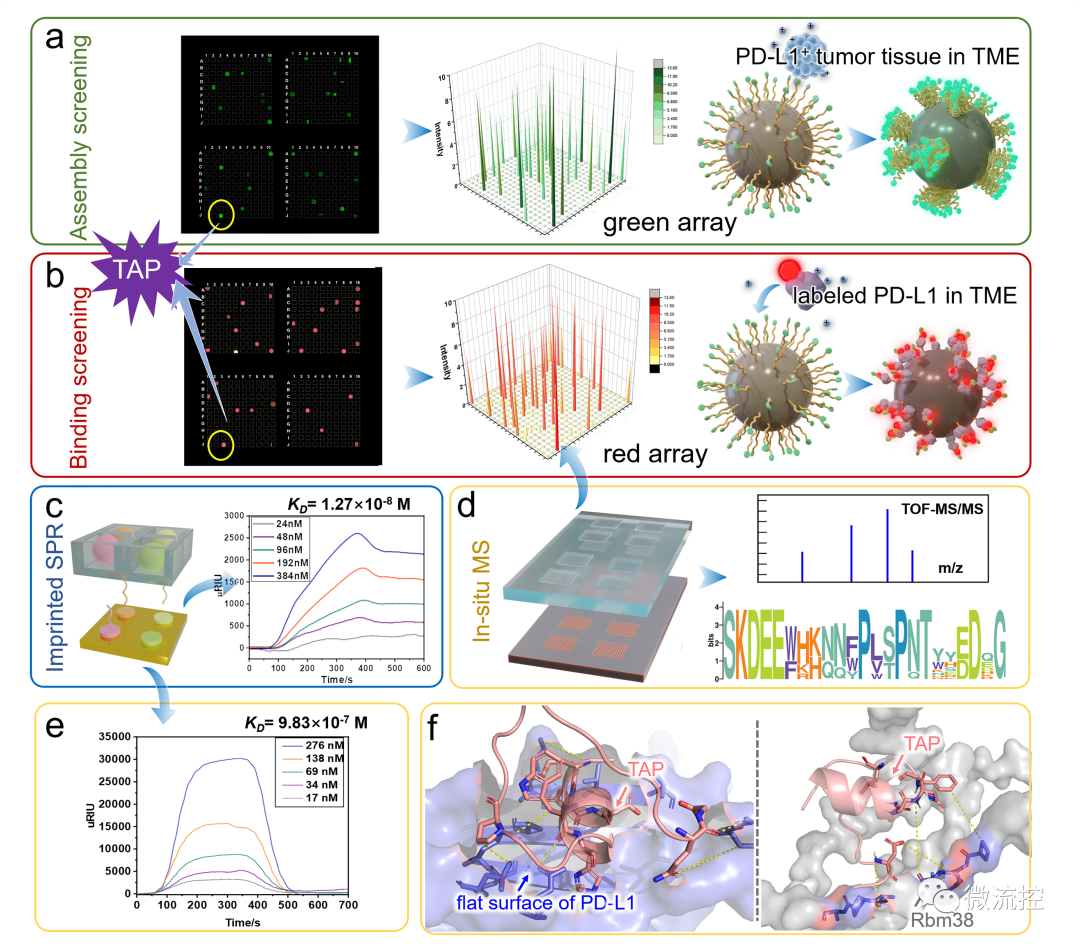 TAP的演化与表征 进一步地,对TAP的生物学性能进行了研究,在分子及细胞水平上证明了TAP不仅能阻断Rbm38-eIF4E复合物的形成上调p53表达,也能阻断PD-1/PD-L1相互作用。值得注意的是,TAP具有全面下调细胞内外PD-L1含量的能力,这进一步增加了其活体诊疗效果。同时,由于TAP的组装性能使其在PD-L1的招募下快速形成稳定的纳米纤维进一步促进了其对相关通路的稳定持续调控。总而言之,TAP在细胞膜上自组装阻断PD-L1,同时下调整个细胞中PD-L1的表达,这与其激活p53的能力相结合,使TAP成为一种潜在的强大的抗肿瘤先导分子。 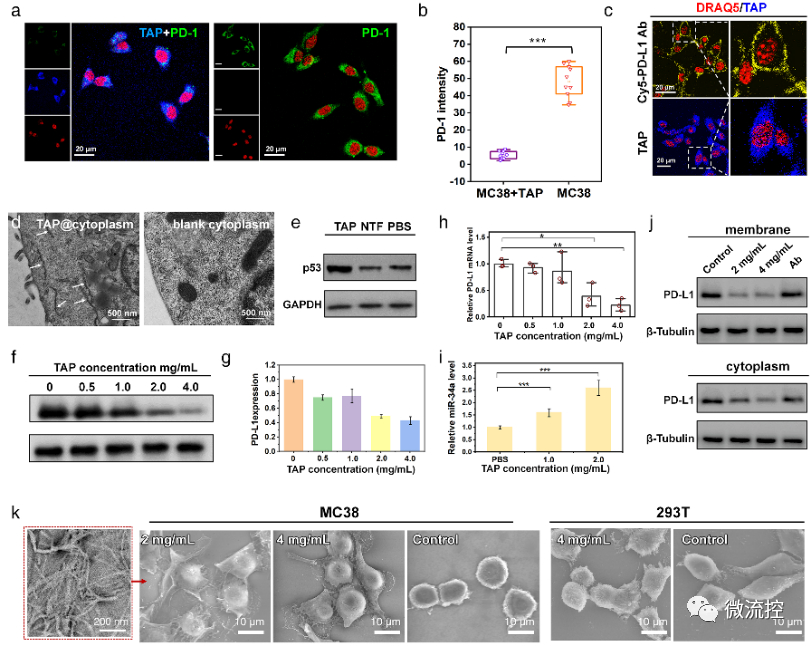 TAP在细胞水平的肿瘤抑制作用 进一步地,通过使用AFM、TEM、CD、XRD及分子动力学模拟等手段对TAP自组装行为进行了研究。证明了其可在肿瘤微环境中能够转变成α-helix结构,并通过对PD-L1的特异性识别和招募下以极低的浓度进行快速组装。 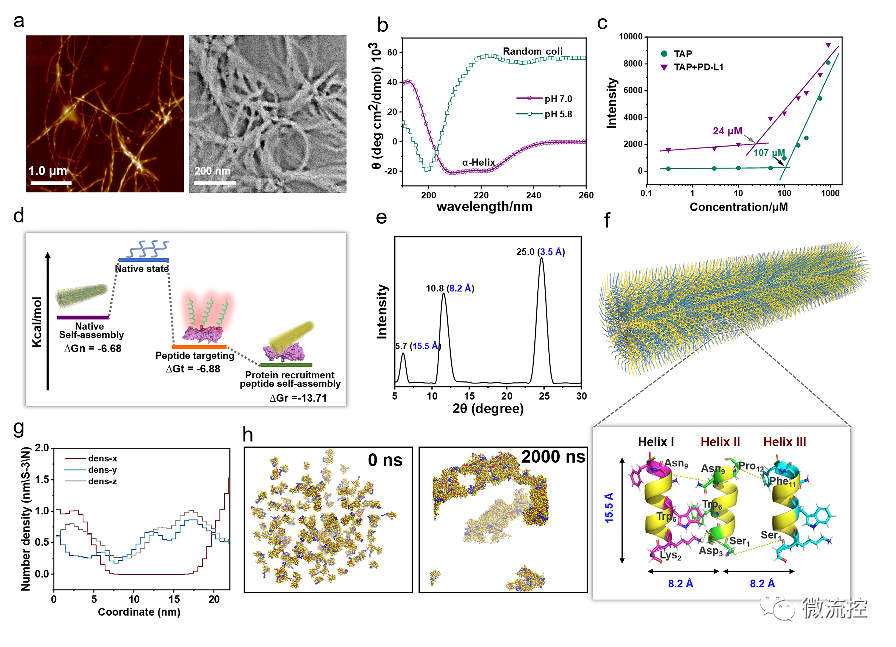 TAP自组装行为的表征 在正常小鼠及免疫抑制小鼠水平上,证实了TAP能特异性的靶向肿瘤组织,并展示出优于抗体的抗肿瘤效果。 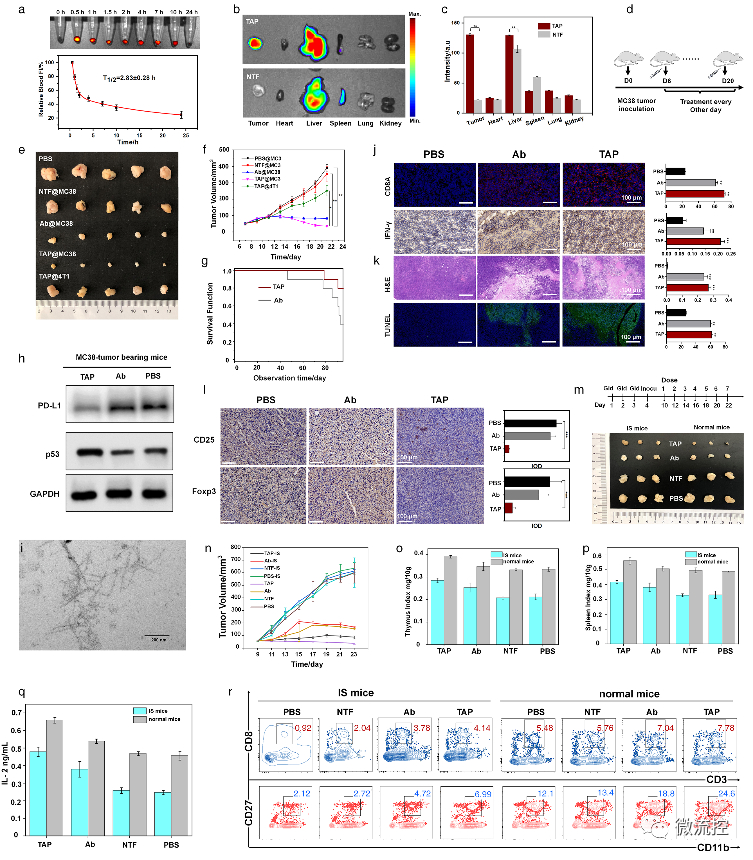 TAP的体内肿瘤抑制作用 为了进一步了解TAP抑癌分子机制,采用了基于RNA测序(RNA-seq)的转录组和基于质谱的蛋白质组方法绘制了遗传和蛋白质组图谱。 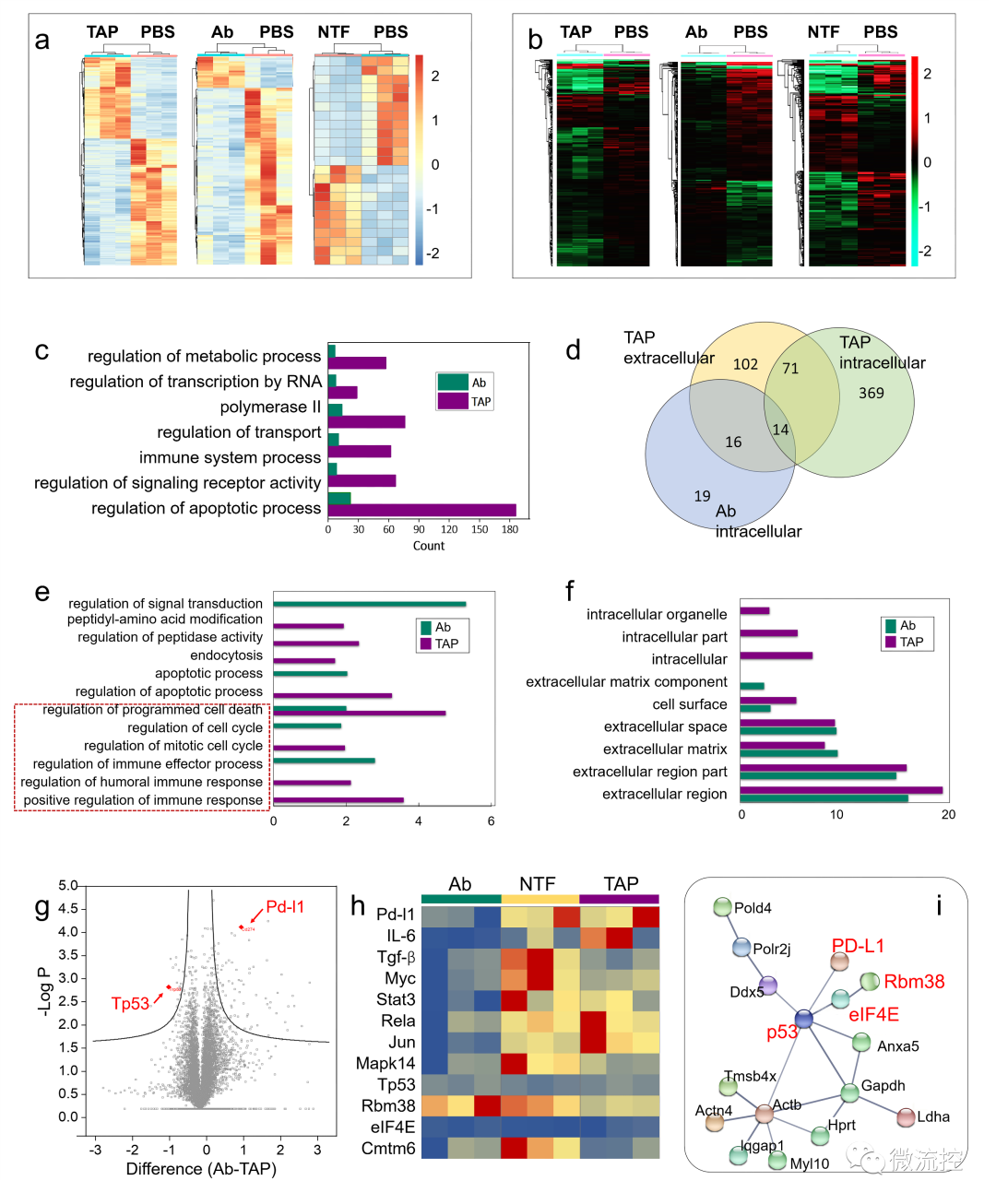 最后,在患者来源肿瘤异种移植(PDX)模型中,对TAP的抗肿瘤效果进行了验证。 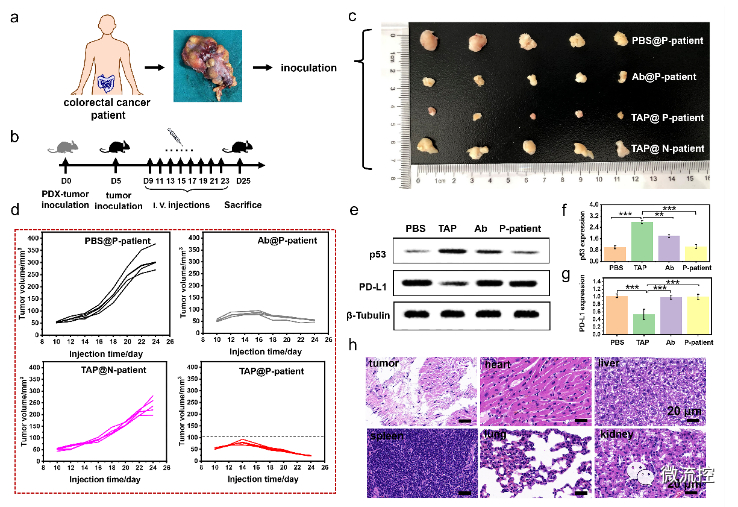 TAP对PDX小鼠的体内治疗效果验证 总的来说,该研究通过基于微流控芯片的靶向多肽多维度进化方法成功筛选出了具有多重性能的新型靶向多肽分子。并在分子、细胞、活体、PDX水平上对其抗肿瘤效果及机制进行了详细的研究。该工作为高内涵靶向多肽的筛选提供了新方法,也为基于分子识别的癌症精准诊疗提供了新思路。 上述成果以“Totipotent ‘All-in-one’ Peptide Sequentially Blocks Immune Checkpoint and Reverses Immunosuppressive Tumor Microenvironment”为题发表在国际顶级期刊Advanced Materials上。北京理工大学为第一通讯单位,化学与化工学院博士研究生张黎民为论文第一作者,北京理工大学王蔚芝研究员为最后通讯作者。新加坡国立大学陈小元教授,国家纳米科学中心胡志远研究员、赵敏芝研究员以及北京理工大学的蒋振奇博士为共同通讯作者。山西省中医院,上海交通大学附属瑞金医院,上海中医药大学附属龙华医院等在患者组织样本及医学伦理评估等方面给予了大力支持。 https://doi.org/10.1002/adma.202207330 文章来源:麦姆斯咨询(“微流控”公众号) |

